1、简答题 如图是由一些常见元素组成的单质及其化合物之间的转化关系图.常温常压下,D、F均为无色无味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体;G是一种红褐色沉淀,且G、H、I、J中都含有同一种元素(反应中生成的部分物质已略去).请回答下列问题:
(1)从反应②的实验现象可以得出物质C具有的某些物理性质有(写两点):______.
(2)J暴露在空气中的现象是______.
(3)①--⑦的反应中属于非氧化还原反应的有______.
(4)反应①的化学方程式为______.
(5)将115g甲酸(HCOOH)完全燃烧后的产物通过足量的固体A中,固体A将增重______g.
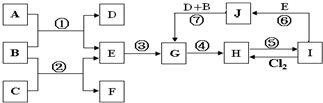
参考答案:A是由单质C在D中燃烧生成的淡黄色固体,应为Na2O2,B是最常见的无色液体,应为H2O,则D为O2,E为NaOH,C为Na,F为H2,G是一种红褐色沉淀,为Fe(OH)3,且G、H、I、J中都含有同一种元素,由转化关系可知,都含有Fe元素,由反应⑦可知,J为Fe(OH)2,I与与NaOH反应得到J、氯气反应得到H,可推知I为FeCl2,H为FeCl3,
(1)反应②是Na与水反应,从实验现象可以得出物质Na具有的某些物理性质:银白色金属、固体、密度比水小、熔点低等,
故答案为:银白色金属、固体、密度比水小、熔点低等;
(2)J是Fe(OH)2,暴露在空气中被氧化生成Fe(OH)3,现象是:白色固体迅速变成灰绿色,最后变成红褐色,
故答案为:白色固体迅速变成灰绿色,最后变成红褐色;
(3)反应①过氧化钠与水反应生成氢氧化钠与氧气,属于氧化还有反应,反应②是Na与水生成氢氧化钠与氢气,是置换反应,属于氧化还有反应,反应⑤是氯化铁反应生成氯化亚铁,属于氧化还原反应,反应⑦是氢氧化亚铁氧化生成氢氧化铁,属于氧化还原反应,
反应③是氢氧化钠与铁盐反应生成氢氧化铁,属于非氧化还原反应,反应④是氢氧化铁与盐酸反应生成氯化铁与水,属于非氧化还原反应,反应⑥是氯化亚铁与氢氧化钠反应生成氢氧化亚铁,属于非氧化还原反应,
故答案为:③④⑥;
(4)反应①的化学方程式为:2Na2O2+2H2O=2NaOH+O2↑,故答案为:2Na2O2+2H2O=2NaOH+O2↑;
(5)将115g甲酸(HCOOH)的物质的量=115g46g/mol=2.5mol,完全燃烧生成2.5molCO2,2.5molH2O,通过足量的固体Na2O2中,发生反应2Na2O2+2CO2=2Na2CO3+O2↑,固体增重相当于与CO2等物质的量的CO的质量,发生反应:2Na2O2+2H2O=2NaOH+O2↑,固体增重相当于与H2O等物质的量氢气的质量,故过氧化钠增重=2.5mol×28g/mol+2.5mol×2g/mol=75g,
故答案为:75.
本题解析:
本题难度:简单
2、推断题 有X、Y、Z三种元素,已知
①X、Y、Z的单质在常温下均为气体?
②X单质可在Z单质中燃烧,生成XZ,火焰为苍白色?
③XZ极易溶于水,电离出X+和Z-,其水溶液可使蓝色石蕊试纸变红?
④每2个X2分子可与1个Y2分子化合生成2个X2Y分子,X2Y在常温下为液体?
⑤Z单质溶于X2Y中,所得溶液具有漂白作用。
(1)推断X、Y、Z三种元素的名称为X.?__________,Y.?_________,Z.?_________。
(2)化合物的化学式XZ_______________,X2Y_________________。
(3)五个过程中涉及的化学反应的方程式为_____________________、______________________、______________________。
参考答案:(1)氢;氧;氯?
(2)HCl;H2O
(3)H2+Cl2 2HCl;2H2+O2
2HCl;2H2+O2 2H2O;Cl2+H2O==HCl+HClO
2H2O;Cl2+H2O==HCl+HClO
本题解析:
本题难度:一般
3、选择题 在一种酸性溶液中,存在NO3-、I一、Cl一、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此推断溶液中? (? )
A.一定有碘离子,不能确定是否含有氯离子
B.一定含有硝酸根离子
C.一定含有碘离子、氯离子、硝酸根离子
D.不含铁离子和硝酸根离子
参考答案:AD
本题解析:略
本题难度:简单
4、填空题 (14分)下面的框图中涉及A~L十几种物质。其中H是一种无色无味的单质气体,D在较高温度下是气体,但常温时为无色液体,E为含钠的化合物。
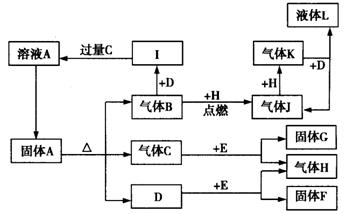
根据上述信息回答下列问题:
(1)写出L的化学式:____________。
(2)写出C与E反应的化学方程式:_____________________________。
(3)由溶液A制备固体A的实验操作方法是:____________________________;
(4)举例说明大气中生成气体J的方法:___________________________________。
(5)写出A溶液与过量F溶液在加热条件下反应的离子方程式:________________。
参考答案:

本题解析:略
本题难度:一般
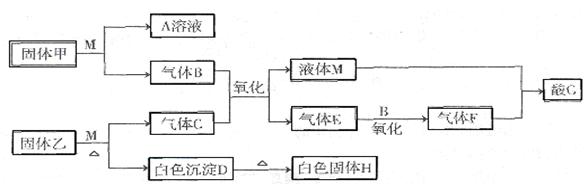
5、填空题 (15分)I在下图转化关系中,固体甲的焰色反应呈黄色,M为常见的液体物质,酸G是重要的化工产品和化工原料;固体H能溶解在A和酸G且H为良好的耐火材料(图中部分产物没有列出)。
II如图表示的是生产酸G的工业流程:
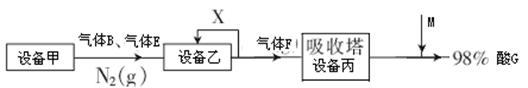
(1)乙设备的名称为?固体乙的化学式为?M分子的结构式为?。
(2)气体X的主要成分为?。
(3)写出设备甲中常见的化学反应?。
(4)白色沉淀D与G溶液反应的离子方程式为?。
(5)将2.24 L(标准状况下)E通入100 mL2 mol/L A的水溶 液后,溶液中离子浓度由大到小的顺序为____________?___。
液后,溶液中离子浓度由大到小的顺序为____________?___。
(6)电解熔融固体H可制得一种金属,则电解化学方程式为?当电解时转移2.4mol电子,制得金属?g。
参考答案:
(1)接触室(1分)?Al2S3?(1分)? H——O——H?(1分)
(2)SO2、O2、N2(2分)
(3)4FeS2 + 11O2 2Fe2O3 + 8SO2(2分,其他合理也给分)
2Fe2O3 + 8SO2(2分,其他合理也给分)
(4)Al(OH)3? + 3H+ ="==" Al3+ + 3H2O?(2分)
(5)c(Na*)>c(SO32-)>c(OH-)>c(HSO3-)>c(H*)?(2分)
(6)2Al2O3 4 Al + 3O2↑(只要有通电或电解条件即可)(2分)?21.6g(2分)
4 Al + 3O2↑(只要有通电或电解条件即可)(2分)?21.6g(2分)
本题解析:略
本题难度:一般