1、填空题 1)相同物质的量浓度下的各溶液:NaX、NaY、NaZ,其PH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序为:?
(2)将AlCl3溶于水后,经加热蒸发、蒸干,灼烧,最后所得白色固体的主要成分是??
(3)把a、b、c、d四种金属片浸泡在稀硫酸中,用导线两两相连,可以组成各种原电池。若a b相连,a为负极;c d相连,c为负极;a c相连,c为正极;b d相连,b为正极,则四种金属的活动性由强到弱顺序为:?
(4)写出Na2CO3溶于水后的电离方程式:? ________________________________________________________
(5)写出氯化铁溶液水解反应的离子方程式: ______________________________________________
参考答案:1)HX>HY>HZ (2)Al2O3?(3)a>c>d>b
(4)Na2CO3 =" 2" Na++ CO32-?(5)Fe3+ + 3H2O 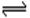 ?Fe (OH)3 + 3H+
?Fe (OH)3 + 3H+
本题解析:略
本题难度:简单
2、选择题 如图所示装置中,当闭合K时,下表中装置的描述正确的一项是
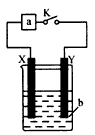
[? ]
a?
X极材料
Y极材料
? b
对装置的描述
A.
电流表?
石墨
铜
氯化铁溶液
铜为负极,石墨电极质量增加
B.
电流表?
铁
铜
盐酸
电子流动路径是:铁→外电路→铜→
盐酸→铁,从而构成闭合回路
C.
直流电源?
石墨
石墨
硫酸
?溶液的pH始终保持不变
D.
直流电源
?铜
铁
硫酸铜溶液
溶液中Cu2+的浓度可能保 持不变
参考答案:D
本题解析:
本题难度:一般
3、选择题 下列化学反应的化学能可直接转变成电能的是
[? ]
A.2FeCl3+Cu=CuCl2+2FeCl2
B.AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl
C.2Fe(OH)3=Fe2O3+3H2O
D.Na2O+CO2=Na2CO3
参考答案:A
本题解析:
本题难度:简单
4、填空题 为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如下图:
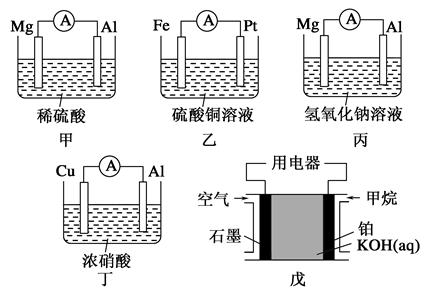
回答下列问题:
(1)根据原电池原理填写下表:
装置序号
| 正极
| 负极反应式
| 阳离子移动方向
|
甲
| ?
| ?
| ?
|
乙
| ?
| ?
| ?
|
丙
| ?
| ?
| ?
|
丁
| ?
| ?
| ?
|
戊
| ?
| ?
| ?
|
?
(2)电极类型除与电极材料的性质有关外,还与________有关。
(3)根据上述电池分析,负极材料是否一定参加电极反应?_____
(填“是”“否”或“不一定”),请举例说明:__________________________________________。
(4)指出下列电池的放电过程中,电解质溶液酸碱性的变化:甲_______,丙_______,戊_______。(填酸性或碱性增强或减弱)
参考答案:(1)
装置
序号
正极
负极反应式
阳离子
移动方向
甲
Al
Mg-2e-=Mg2+
铝极
乙
Pt
Fe-2e-=Fe2+
铂极
丙
Mg
Al-3e-+4OH-=AlO2-+2H2O
镁极
丁
Al
Cu-2e-=Cu2+
铝极
戊
石墨
CH4-8e-+10OH-=CO32-+7H2O
石墨
?
(2)电解质溶液的性质
(3)不一定 上述五个原电池中,戊装置的负极材料没有参与反应,其他电池的负极发生了氧化反应
(4)酸性减弱 碱性减弱 碱性减弱
本题解析:(1)电池甲:在稀硫酸中,镁比铝活泼,镁为负极,发生氧化反应,铝为正极,H+在铝极上发生还原反应;
乙电池:铁比铂活泼,铁为负极;
丙电池:在氢氧化钠溶液中,铝与NaOH溶液反应,铝失去电子,发生氧化反应,铝离子与氢氧化钠反应生成偏铝酸根离子和水;
丁电池:常温下,浓硝酸使铝钝化,铜溶解,铜为负极;
戊电池是燃料电池,甲烷与氧气反应,甲烷发生氧化反应,在碱中生成碳酸盐和水,氧气发生还原反应。所以。在负极区通入甲烷,在正极区通入空气。
(2)通过比较甲、丙电池可知,电极都是铝、镁,由于电解质溶液不同,故电极名称不同,即电极类型与电极材料、电解质溶液都有关。
(3)大多数电池的负极材料参与反应发生氧化反应,燃料电池的负极材料不参与反应,可燃物如氢气、一氧化碳、甲烷、乙醇等在负极区发生氧化反应。
(4)根据溶液中离子参加反应情况判断溶液酸碱性的变化。
本题难度:一般
5、填空题 (6分)用铜、银与硝酸银设计一个原电池,此电池的负极是:?,
负极的电极反应式是:?,
总反应方程式为?。
参考答案:负极是 Cu ,负极的电极反应式 Cu - 2e- ="=" Cu2+;总反应式 Cu + 2Ag+ ="=?" 2Ag + Cu2+。
本题解析:略
本题难度:简单