1、选择题 关于如图所示的原电池,下列说法错误的是( )
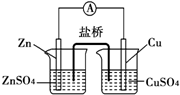
A.电子从锌电极通过电流计流向铜电极
B.盐桥中的阳离子向硫酸铜溶液中迁移
C.锌电极发生氧化反应,铜电极发生还原反应
D.铜电极上发生的电极反应为2H++2e-═H2↑
参考答案:A.该原电池中,锌是负极,铜是正极,电子从锌电极通过电流计流向铜电极,故A正确;
B.该原电池中,锌是负极,铜是正极,放电时,盐桥中的阳离子向正极硫酸铜溶液中迁移,故B正确;
C.该原电池中,锌是负极,铜是正极,负极上锌失电子发生氧化反应,正极上铜离子得电子发生还原反应,故C正确;
D.铜电极上铜离子得电子发生还原反应,故D错误;
故选D.
本题解析:
本题难度:一般
2、填空题 某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,盐桥中装有饱和K2SO4溶液。回答下列问题:
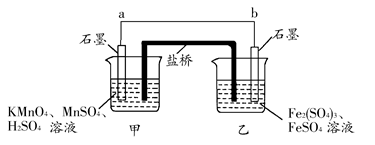
(1)发生氧化反应的烧杯是________(填“甲”或“乙”)。
(2)外电路的电流方向为:从________到________。(填“a”或“b”)
(3)电池工作时,盐桥中的SO42—移向________(填“甲”或“乙”)烧杯。
(4)甲烧杯中发生的电极反应为______________________________。
参考答案:(1)乙 (2)a b (3)乙
(4)MnO4—+8H++5e-=Mn2++4H2O
本题解析:根据氧化还原反应可知:甲烧杯中石墨作正极,发生还原反应,电极反应为:MnO4—+8H++5e-=Mn2++4H2O;乙烧杯中石墨作负极,发生氧化反应,电极反应为Fe2+-e-=Fe3+,外电路电流方向从正极流向负极,即从a到b。电池工作时,盐桥中的阴离子移向负极,阳离子移向正极,即SO42—移向乙烧杯。
本题难度:一般
3、填空题 仔细分析如图装置,完成下面的填空。
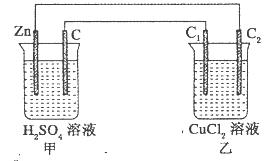
(1)—段时间后,可能发现的现象是:甲池,Zn棒逐渐溶解,碳棒上有__________产生。与Zn棒相连的碳棒(C2)质量____________(填“增大”、“减小”或“不变”)。
(2)甲池Zn极为__________极,电极反应式:_____ _______________________________,乙池中C1为__________极,电极反应式为:________________________________________,乙池总反应式为:________________________________________________。
参考答案:(共10分)(1)气体(或气泡);(1分)增大(1分)
(2)负;(1分)Zn-2e-= Zn2+;(2分)?阳(1分)2 Cl--2e-= Cl2↑(2分)CuCl2 Cu+ Cl2↑
Cu+ Cl2↑
本题解析:(1)由图知甲为原电池装置,Zn作负极,碳棒作正极,碳棒上有气体产生,乙为电解池装置,与Zn棒相连的碳棒(C2)是阴极,有铜析出,质量增大;
(2)甲池Zn极为负极,电极反应式:Zn-2e-= Zn2+;乙池中C1为阳极电极反应式为:2 Cl--2e-= Cl2↑乙池实际是电解Cu Cl2总反应式为CuCl2 Cu+ Cl2↑
Cu+ Cl2↑
本题难度:一般
4、选择题 如图所示装置中,可观察到电流计指针偏转,M棒变粗,N棒变细。下表所列M、N、P物质中,可以组合成该装置的是(?)
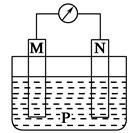
选项号
| M
| N
| P
|
A
| 锌
| 铜
| 稀硫酸
|
B
| 铜
| 铁
| 稀盐酸
|
C
| 银
| 锌
| 硝酸银溶液
|
D
| 锌
| 铁
| 硝酸铁溶液
|
?
参考答案:C
本题解析:M棒变粗,N棒变细,说明N棒是负极,相对M棒金属活动性更强。M棒变粗说明M棒上有金属析出。
本题难度:简单
5、选择题 下列装置能够组成原电池,产生电流的是
[? ]
A.
B.
C.
D.
参考答案:BC
本题解析:
本题难度:简单