1、填空题 二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一。
(1)一定条件下,2SO2(g)+O2(g)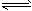 2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和
2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和
0.2mol SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K=
_________;恒温下,若往容器中再加入2 mol SO2(g),则重新达到平衡时SO2的总转化率_______50%(选填“>”、“<”或“=”)。
(2)用CH4催化还原NOx为N2可以消除氮氧化物的污染。现有1L NO2、NO混合气体NOx,将其还原成
N2,需同温同压下CH4的体积0.4L,则混合气体中NO2、NO的物质量之比为_________。
(3)新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示
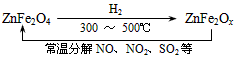
若2mol ZnFe2Ox与SO2可生成0.75 mol S,x=_________。求可分解⑵中混合气体体积V(标准状况下)。(写出计算过程)
参考答案:(1)5.76;<
(2)3∶2
(3)3.25;21
本题解析:
本题难度:一般
2、填空题 (6分)(1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g) CO2(g)十H2 (g),△H<0。CO和H2O浓度变化如下图,则0~4min的平均反应速率υ(CO)=?mol/(L·min),此时该反应的平衡常数为?。
CO2(g)十H2 (g),△H<0。CO和H2O浓度变化如下图,则0~4min的平均反应速率υ(CO)=?mol/(L·min),此时该反应的平衡常数为?。
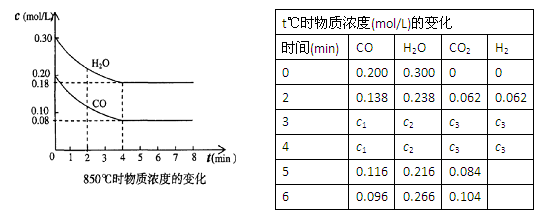
(2)T ℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min~4min之间反应处于? ?状态;c1?0.08 (填 “>”、“<”或“=”)。
?状态;c1?0.08 (填 “>”、“<”或“=”)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是?(填序号,下同),表中5min~6min之间数值发生变化,可能的原因是?。
a.增加了水蒸气的量? b.降低温度
c.使用催化剂? d.增加氢气的浓度
参考答案:(6分)(1)0.03,1?(2)平衡,>,d,a
本题解析:略
本题难度:一般
3、填空题 (8分) 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)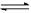 CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:?
CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:?
t℃
| 700
| 800
| 830
| 1000
| 1200
|
K
| 0.6
| 0.9
| 1.0
| 1.7
| 2.6
|
请回答下列问题:(1)该反应的化学平衡常数K =?。
(2)该反应为?反应。(填“吸热”或“放热”)
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为?℃。
(4)830℃,在1 L的固定容器的密闭容器中放入2 mol CO2和1 mol H2,平衡后CO2的转化率为?,
参考答案:(共8分,每空2分)
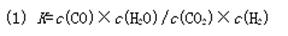
?(2)吸热(3)830(4)1∕3
本题解析:略
本题难度:简单
4、选择题 将BaO2放入密闭的真空容器中,反应2BaO2(s) 2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
A.平衡常数减小
B.BaO量不变
C.氧气压强不变
D.BaO2量增加
参考答案:CD
本题解析:A.平衡常数只与温度有关,温度不变,平衡常数就不变。错误。B. 该反应的正反应是气体体积增大的反应。保持温度不变,缩小容器容积,也就增大了压强,根据平衡移动原理,化学平衡向气体体积减小的反应,即向逆反应方向移动,所以BaO量减小。错误。C.由于温度不变,化学平衡常数就不变,其数值就等于氧气的浓度,浓度不变,因此压强不变。正确。D. 缩小容器容积,平衡逆向移动,所以体系重新达到平衡BaO2量增加。正确。
本题难度:一般
5、选择题 在一定温度下,向a L密闭容器中加入一定量A、B气体,发生如下反应:A2(g)+3B(g)  2C2 (g)+2D(g),可以作为反应达到平衡的标志是(C? )
2C2 (g)+2D(g),可以作为反应达到平衡的标志是(C? )
A.容器中总压强不随时间变化而变化
B.单位时间内断裂一个A-A键,同时生成两个C-C键
C.v正(B)=0.03mol/(L?s),v逆(D)=1.2mol/(L?min)
D.容器中气体的平均相对分子质量不随时间变化而变化
参考答案:C
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。反应前后体积不变,所以压强始终是不变的,A不正确。B中反应速率的方向是相同的,不正确。C中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量和物质的量都是不变的,所以D不正确。答案选C。
本题难度:简单