1、选择题 X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y?2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于( )
A.35%
B.40%
C.50%
D.65%
2、计算题 (6分)在500℃容积为2升的密闭容器中充入SO2和O2,其中SO2的浓度为1mol/L,经10秒后,达到平衡,2SO2(g)+O2(g) 2SO3(g),此时容器中SO3的浓度为0.9mol/L,O2的物质的量为2.1mol,试求:① SO2的转化率;② O2的起始浓度(mol/L);③ SO2的平均反应速率(mol/L· min)
2SO3(g),此时容器中SO3的浓度为0.9mol/L,O2的物质的量为2.1mol,试求:① SO2的转化率;② O2的起始浓度(mol/L);③ SO2的平均反应速率(mol/L· min)
3、填空题 (10分)高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+CO(g) 2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)
温度/℃
| 1000
| 1150
| 1300
|
平衡常数
| 4.0
| 3.7
| 3.5
|
已知该反应在不同温度下的平衡常数如下:
请回答下列问题:
(1)该反应的平衡常数表达式K=?,△H?0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率υ(CO2)=?、CO的平衡转化率= ?:
(3)欲提高(2)中CO的平衡转化率,可采取的措施是?。
A.减少Fe的量? B.增加Fe2O3的量? C.移出部分CO2
D.提高反应温度? E.减小容器的容积? F.加入合适的催化剂
4、填空题 利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O=CO+3H2。部分物质的燃烧热数据如下表

已知1mol H2O(g)转变为1mol H2O(l)时放出44.0kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式
_________________________。
(2)500℃、50MPa时,在容积为VL的容器中加入1mol N2、3mol H2,此时N2的转 化率为a。则平衡时
NH3的浓度为______________。
(3)1,3―丙二醇是重要的化工原料,用乙烯合成1,3―丙二醇的路线如下
CH2=CH2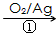
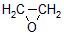
 HOCH2CH2CHO
HOCH2CH2CHO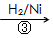 HOCH2CH2CH2OH
HOCH2CH2CH2OH
某化工厂已购得乙烯11.2t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得

假设在生产过程中,反应①、②、③中各有机物的转化率均为100%。且反应②中CO和H2、反应③中H2的转化率都为80%,计算至少需要焦炭___________吨、甲烷_________吨,才能满足生产需要。
5、选择题 在2L固定密闭容器中,充入1molA气体和3molB气体,在温度为T℃下进行下列反应:A(g)+2B(g) 3C(g);△H<0,达到平衡时A转化率为50%.甲、乙两化学小组,控制温度为T℃,分别在2L固定密闭容器中充入一定量A气体和B气体.甲:2molA和6molB;乙:1molA和6molB.记录反应时容器内A的物质的量如表所示,下列说法正确的是( )
3C(g);△H<0,达到平衡时A转化率为50%.甲、乙两化学小组,控制温度为T℃,分别在2L固定密闭容器中充入一定量A气体和B气体.甲:2molA和6molB;乙:1molA和6molB.记录反应时容器内A的物质的量如表所示,下列说法正确的是( )
| t/min | 甲组A的物质的量 | 乙组A的物质的量
0
2
1
5
1.0
0.5
|
A.反应在第5min时,乙组中v(正)<v(逆)
B.反应在第5min时,甲组中3v(B正)=2v(C逆)
C.反应在第5min时,甲、乙两组均处于化学平衡状态
D.前5min中,甲组用A表示的化学反应速率为v(A)=0.2mol/(L?min)