1、推断题 A、B、D是三种常见的短周期元素,它们的原子序数逐渐增大,B是第三周期中离子半径最小的元素,且其原子最外层电子数为D元素原子最外层电子数的一半。A元素原子最外层电子数比B多一个。甲、乙、丙是三种元素最高价含氧酸的含钠元素的盐,甲中含B元素,乙中含D元素,丙中含A元素。甲、丙的水溶液均有较强的碱性,乙的水溶液pH小于7。戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图:(图中略去了物质转化时的部分生成物)
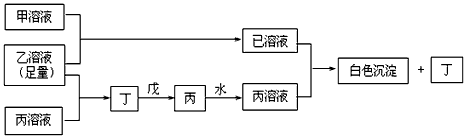
(1)B的元素符号为:___________; 乙的化学式为___________;
(2)己溶液与丙溶液的反应方程式为______________________;
(3)若乙溶液不足量,乙溶液分别和甲、丙溶液也能发生反应;但生成物不是己和丁,写出将少量的乙溶液滴入甲溶液反应的离子方程式:______________________;
(4)若用乙溶液为标准液来滴定未知浓度的丙溶液,则乙应当盛放在_______滴定管中(填酸式、碱式)。若在滴定前用蒸馏水润洗锥形瓶但没有干燥,则测得的结果与真实值相比_________(填偏大、相等、偏小)。若选用酚酞为指示剂,则滴定终点的产物为___________。
参考答案:(1)铝(或Al );NaHSO4
(2)2Al3++ 3CO32-+3H2O==2Al(OH)3↓ + 3CO2↑
(3)H++AlO2-+H2O=Al(OH)3↓
(4)酸式;相等;NaHCO3
本题解析:
本题难度:一般
2、选择题 下列事实能说明氯元素的非金属性比硫元素强的是( )
①还原性:Cl-<S2-
②Cl2能与H2S反应生成S
③HClO4的酸性比H2SO4的强
④常温下Cl2是气体,S是固体.
A.①②③
B.①②④
C.①③④
D.②③④
参考答案:①还原性:Cl-<S2-,则非金属性Cl>S,能说明氯元素的非金属性比硫元素强;
②Cl2能与H2S反应生成S,则非金属性Cl>S,能说明氯元素的非金属性比硫元素强;
③HClO4的酸性比H2SO4的强,则非金属性Cl>S,能说明氯元素的非金属性比硫元素强;
④常温下Cl2是气体,S是固体,为物理性质,不能比较非金属性,
故选A.
本题解析:
本题难度:一般
3、选择题 下列说法正确的是?
[? ]
A、汽油、煤油、植物油都可以燃烧,它们的主要成分也相同 ?
B、根据元素原子最外层电子数的多少可将元素分为金属元素和非金属元素 ?
C、我们要大力发展太阳能光伏产业,该产业的主要原料之一是硅及其化合物 ?
D、钠融法、铜丝燃烧法、元素分析仪、质谱法均可确定有机化合物的元素组成
参考答案:C
本题解析:
本题难度:简单
4、选择题 X、Y、Z三种元素位于周期表中同一周期,它们的最高价氧化物分别为酸性氧化物、碱性氧化物、两性氧化物,则三种元素原子序数的大小顺序为( )
A.X>Y>Z
B.Y>Z>X
C.X>Z>Y
D.Z>X>Y
参考答案:C
本题解析:试题分析:同一周期自左向右非金属性逐渐增强,金属性逐渐减弱,所以根据最高价氧化物分别为酸性氧化物、碱性氧化物、两性氧化物,且位于同一周期可知,X的原子序数最大,Z是Al,Y的原子序数小于Al的,答案选C。
考点:考查元素周期表的结构和元素周期律的应用
点评:该题的关键是利用两性氧化物判断出Z是Al元素,然后借助于元素周期律进行分析即可。
本题难度:一般
5、选择题 下列各组物质的性质比较,正确的是( )
A.酸性:
B.氢化物稳定性:HCl>H2S>H2O
C.碱性:NaOH>Mg(OH)2>Al(OH)3
D.离子半径:Na+>Mg2+>Cl-
参考答案:A.非金属性:Cl>S>P,元素的非金属性越强,对应最高价氧化物的水化物的酸性越强,则酸性:HClO4>H2SO4>H3PO4,故A错误;
B.非金属:O>Cl>S,元素的非金属性越强,对应的氢化物越稳定,则稳定性:H2O>HCl>H2S,故B错误;
C.金属性:Na>Mg>Al,元素的金属性越强,对应最高价氧化物的水化物的碱性越强,则碱性:NaOH>Mg(OH)2>Al(OH)3,故C正确;
D.离子的核外电子层数越多,离子半径越大,Na+和Mg2+核外有2个电子层,Cl-核外有3个电子层,则离子半径最大的是Cl-,故D错误.
故选C.
本题解析:
本题难度:一般