| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《热化学方程式》高频试题巩固(2017年最新版)(四)
②除上述必需的仪器外,还缺少的主要玻璃仪器是 。 ⑶肼能使锅炉内壁的铁锈变成较为致密的磁性氧化铁(Fe3O4)层,以减缓锅炉锈蚀。若反应过程中肼转化为氮气,则每生成1molFe3O4,需要消耗肼的质量为 g。 ⑷磁性氧化铁(Fe3O4)的组成可写成FeO·Fe2O3。某化学实验小组通过实验来探究一黑色粉末是否由Fe3O4、CuO组成(不含有其它黑色物质)。探究过程如下: 提出假设:假设1. 黑色粉末是CuO;假设2. 黑色粉末是Fe3O4; 假设3. 。 探究实验: 取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。 ①若假设1成立,则实验现象是 。 ②若所得溶液显血红色,则假设 成立。 ③为进一步探究,继续向所得溶液加入足量铁粉,若产生 现象,则假设3成立。 有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显。查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)42++4H2O。 ④为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生 现象;若产生 现象,则假设3成立。 参考答案:⑴N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH1=-64a kJ·mol-1 ; ⑵ ①BG;②温度计;⑶8g 本题解析:⑴根据题意可得反应的热化学方程式为N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH1=-64a kJ/mol;(2)①在蒸馏过程中需要的仪器是酒精灯、蒸馏烧瓶、温度计、直型冷凝管、尾接管(接液管)、锥形瓶。所以不需要的玻璃仪器是长直玻璃导管、滴定管。因此选项为BG。②除上述必需的仪器外,还缺少的主要玻璃仪器是温度计;⑶肼与Fe2O3反应的方程式是N2H4+6Fe2O3= 4Fe3O4+ N2+2H2O。根据方程式可知,若生成1molFe3O4,需要消耗肼0.25mol,它的质量为0.25mol×32g/mol=8g。⑷根据给出的假设情况可推知假设3是黑色粉末是CuO和Fe3O4的混合物 ;取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。 ①若假设1成立,则实验现象是溶液显蓝色;②若所得溶液显血红色,则假设“2或3”成立;③为进一步探究,继续向所得溶液加入足量铁粉,若产生红色固体则假设3成立。 ④为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生红褐色氢氧化铁沉淀 ;若产生的现象是既有红褐色沉淀,同时溶液呈深蓝色,则假设3成立。 本题难度:困难 4、简答题 如图,研究碳、氮、硫的氧化物的性质对化工生产和环境保护有重要意义.
△H=594.1kJ/mol.请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式:______. (3)硫酸工业生产中,SO2催化氧化生成SO3反应为2SO2+O2?2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图. 根据图示回答下列问题: ①2SO2(g)+O2(g)+O2(g)?2SO3(g)的△H______0?(填“>”或“<”). ②若温度T1、T2时,反应的化学平衡常数分别为K1、K2,则K1______K2;若反应进行到状态D时,v正______v逆(填“>”“<”或“=”). 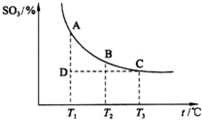 参考答案:(1)a.大量化石燃料的燃烧是二氧化碳的主要来源,减少化石燃料的使用,开发新能源,有利于降低大气中的CO2、SO2、NO2浓度,故a正确; 本题解析: 本题难度:一般 5、填空题 A、D、E、X、Y是原子序数依次增大的短周期元素。其中X原子最外层电子数是内层电子总数的3倍;X、Y同族;A与X、Y既不同族也不同周期;D元素的某种同位素在考古方面有重要应用。 参考答案:(2)离子键、共价键 本题解析: 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《物质的分类.. | |