1、选择题 反应2X(g)+Y(g)═2Z(g)+热量,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( )
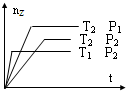
A.T1<T2,P1<P2
B.T1<T2,P1>P2
C.T1>T2,P1>P2
D.T1>T2,P1<P2
参考答案:C
本题解析:
本题难度:简单
2、选择题 已知一定温度下,X(g)+2Y(g)?mZ(g);△H=-akJ/mol(a>0),现有甲、乙两容积相等且固定的密闭容器,在保持该温度下,向密闭容器甲中通入1molX和2molY,达到平衡状态时,放出热量bkJ;向密闭容器乙中通入2molX和4molY,达到平衡状态时,放出热量ckJ,且2b<c,则下列各值关系正确的是( )
A.a=b
B.2a<c
C.m>3
D.m<3
参考答案:A、因该反应为可逆反应,a为X、Y按照反应完全转化时放出的能量,而向密闭容器甲中通入1molX和2molY,不会完全转化,则a>b,故A错误;
B、因可逆反应一定不能完全转化,则2molX和4molY反应时完全转化的能量一定大于在化学平衡中放出的能量,则应为2a>c,故B错误;
C、因为定容,若m=3,则应有2b=c,则若m>3,平衡逆向移动,则放出的热量的关系应为2b>c,则与2b<c矛盾,故C错误;
D、因为定容,若m<3,乙中的物质的量大,压强大,则正向移动的趋势大,放出的热量2b<c,故D正确;
故选D.
本题解析:
本题难度:一般
3、选择题 符合图1、图2的反应是
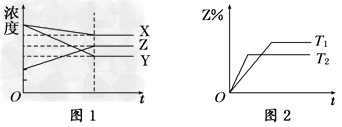
[? ]
A.X(g)+3Y(g) 2Z(g);ΔH>0
2Z(g);ΔH>0
B.X(g)+3Y(g) 2Z(g);ΔH<0
2Z(g);ΔH<0
C.X(g)+2Y(g) 3Z(g);ΔH<0
3Z(g);ΔH<0
D.5X(g)+3Y(g) 4Z(g);ΔH<0
4Z(g);ΔH<0
参考答案:B
本题解析:
本题难度:一般
4、选择题 在密闭容器中进行A(g)+4B(g) 2C(g)+3D(g)的反应,其中A、B、C、D的起始浓度分别为0.1 mol·L-1、0.4 mol·L-1、0.2 mol·L-1、0.3 mol·L-1,当反应达到平衡时,各物质的物质的量浓度不可能是(?)
2C(g)+3D(g)的反应,其中A、B、C、D的起始浓度分别为0.1 mol·L-1、0.4 mol·L-1、0.2 mol·L-1、0.3 mol·L-1,当反应达到平衡时,各物质的物质的量浓度不可能是(?)
A.c(A)="0.15" mol·L-1? B.c(B)="0.8" mol·L-1
C.c(C)="0.3" mol·L-1? D.c(D)="0.5" mol·L-1
参考答案:B
本题解析:可逆反应不可能进行完全。
本题难度:简单
5、填空题 全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%。

⑴ (2分)地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以描述分为下列三步(用“C5”表示C5H10O4,用“C3”表示C3H6O3):
Ⅰ、H2O(l)=2H+(aq)+1/2O2(g)+2e- △H=+284kJ·mol-1
Ⅱ、CO2(g)+C5(s)+2H+(aq)=2C3+(s) △H=+396kJ·mol-1
Ⅲ、12C3+(s)+12e-=C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=-1200 kJ·mol-1
写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式
。
⑵ (8分)降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
△H=-49.0 kJ·mol-1。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
① 从反应开始到平衡,氢气的平均反应速率
v(H2)= mol·(L·min)-1;
② 氢气的转化率= ;
③ 该反应的平衡常数为 (保留小数点后2位);
④ 下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是 。
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去
D.再充入1mol CO2和3mol H2