1、填空题 甲醇是一种优质燃料,可制作燃料电池。
(1)为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如右图。请回答:

①从反应开始到平衡,氢气的反应速率:v(H2)= 。
②能够说明该反应已达到平衡的是_________。
A.恒温、恒容时,容器内的压强不再变化
B.恒温、恒容时,容器内混合气体的密度不再变化
C.一定条件下,CO、H2和CH3OH的浓度保持不变
D.一定条件下,单位时间内消耗3molH2的同时生成1molCH3OH
③下列措施中能使平衡混合物中n(CH3OH)/n(CO2)增大的是 。
A.加入催化剂 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.降低温度
④求此温度(T1)下该反应的平衡常数K1= (计算结果保留三位有效数字)。
⑤另在温度(T2)条件下测得平衡常数K2,已知T2>T1,则K2 (填“>”、“=”或“<”)K1。
(2)以CH3OH为燃料(以KOH溶液作电解质溶液)可制成CH3OH燃料电池(电池总反应式:2CH3OH+3O2+4OH-=2CO32-+6H2O),则充入CH3OH的电极为 极,充入O2的电极反应式 。
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1
②2CO(g)+O2(g)=2CO2(g) △H2
则1mol甲醇不完全燃烧生成一氧化碳和气态水时反应的△H= 。(用含△H1、△H2的式子表示)
参考答案:(1)①0.225mol/(L·min) ② A C ③C D ④5.33 ⑤<
(2)①负; ②3O2+12e-+6H2O=12OH-(O2+4e-+2H2O=4OH-也算对) (3)
本题解析:(1)①根据图像可知,反应进行到10min是物质的浓度不再发生变化,反应达到平衡状态,此时生成甲醇的物质的量浓度是0.75mol/L,则根据反应的方程式可知,消耗氢气的浓度是0.75mol/L×3=2.25mol/L,所以v(H2)=2.25mol/L÷10min=0.225mol/(L?min)。
②在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,据此可以判断。A、根据方程式可知,反应两边气体的体积不相等,恒温、恒容时在反应过程中压强是变化的,当容器内的压强不再变化使,可以证明正逆反应速率相等,达到了平衡状态,故A正确;B、密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,即气体的密度始终不变,所以恒温、恒容时,容器内混合气体的密度不再变化不能说明反应是否达到平衡状态,B不正确;C、一定条件下,CO、H2和CH3OH的浓度保持不变,说明正逆反应速率,达到了平衡状态,故C正确;D、根据方程式可知,一定条件下,单位时间内消耗3molH2的同时,必然生成1molCH3OH,因此用H2、CH3OH的物质的量浓度变化表示的反应速率的比为3:1的状态,不能判断正逆反应速率是否相等,故D错误,因此答案为A、C。
③A、催化剂不能改变平衡状态,所以加入催化剂不能使平衡混合物中n(CH3OH)/n(CO2)增大,A不正确;B、充入He气,参加反应的物质的浓度不变,平衡不移动,即平衡混合物中n(CH3OH)/n(CO2)不变,故B错误;C、将H2O(g)从体系中分离,生成物浓度减小,平衡向正反应方向移动,则平衡混合物中n(CH3OH)/n(CO2)增大,故C正确;D、该反应正反应为放热反应,则降低温度平衡向正反应方向移动,能使平衡混合物中n(CH3OH)/n(CO2)增大,故D正确,答案选C、D。
④化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,即K= 。达到平衡时,c(CO2)=0.25mol/L,c(CH3OH)=0.75mol/L,根据方程式可知c(H2O)=0.75mol/L。同样根据反应方程式,反应氢气的消耗浓度为生成的甲醇浓度的3倍,所以平衡状态时氢气的浓度为=3mol/L-3×0.75mol/L=0.75mol/L,因此K=
。达到平衡时,c(CO2)=0.25mol/L,c(CH3OH)=0.75mol/L,根据方程式可知c(H2O)=0.75mol/L。同样根据反应方程式,反应氢气的消耗浓度为生成的甲醇浓度的3倍,所以平衡状态时氢气的浓度为=3mol/L-3×0.75mol/L=0.75mol/L,因此K= =
= ≈5.33。
≈5.33。
⑤该反应正方应是放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,所以K2<K1。
(2)原电池中负极失去电子,发生氧化反应。正极得到电子,发生还原反应,所以根据电池总反应式2CH3OH+3O2+4OH-=2CO32-+6H2O可知,甲醇是还原剂,氧气是氧化剂,因此充入CH3OH的电极为负极,氧气在正极通入。由于电解质是=碱性溶液,所以充入O2的电极反应式为3O2+12e-+6H2O=12OH-。
(3)已知反应①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1、②2CO(g)+O2(g)=2CO2(g) △H2,则根据盖斯定律可知,(①-②)÷2即得到反应CH3OH(l)+O2(g)=CO(g)+2H2O(g),所以该反应的反应热△H= 。
。
考点:考查反应速率、平衡常数计算,外界条件对平衡状态的影响和平衡状态的判断;甲醇燃料电池判断以及盖斯定律的应用等
本题难度:困难
2、填空题 Ⅰ.氮是地球上含量丰富的一种元 素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
 (1)在一定体积的恒容密闭容器中,进行如下化学反应: N2(g)+3H2(g) 2NH3(g)
(1)在一定体积的恒容密闭容器中,进行如下化学反应: N2(g)+3H2(g) 2NH3(g)
其化学平衡常数K与温度t的关系如下表:
t/K
| 298
| 398
| 498
| …
|
K/(mol·L-1)2
| 4.1×106
| K1
| K2
| …
|
完成 下列问题:
下列问题:
①比较K1、K2的大小:K1 K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是 (填序号)。
A.2v(H2)(正)=3v(NH3)(逆) B.v(N2)(正)=3v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(2)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式 。[来源:Z_xx_k.Com]
②盐酸肼水溶液中离子浓 度的排列顺序正确的是 (填序号)。
度的排列顺序正确的是 (填序号)。
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5·H2O+])> c(H+)>c(OH-)
C.c(N2H62+)+ c([N2H5·H2O+])+c(H+)= c(Cl-)+c(OH-)
D.c(N2H62+)> c(Cl-)>c(H+)>c(OH-)
Ⅱ.水体中重金属铅的污染问题备受关注。查资料得知Pb4+具有很强的氧化性。水中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2(在水中溶解度小)、Pb(OH)3-、Pb(OH)42-,各形态的物质的量的分数α随溶液pH变化的关系如下图所示:
(1)Pb(NO3)2溶液中,c(Pb2+)/c(NO3-) 1/2(填“>”、“=”、“<”)。
(2)向Pb(NO3)2溶液滴加盐酸,溶液中c(Pb2+)/c(NO3-)没有变大,反而变小并有沉淀生成,则生成的沉淀可能为 。
(3)向Pb(NO3)2溶液中滴加NaOH溶液,溶液也变浑浊,在pH约为 时生成沉淀最多,继续滴加NaOH溶液,混合体系又逐渐变澄清。pH = 13时,混合体系中发生的主要反应的离子方程式为:  。
。
参考答案:Ⅰ.(1)①>(2分) ②AC
 (2)① N2H62++H2O [N2H5·H2O]+ + H+ ②A
(2)① N2H62++H2O [N2H5·H2O]+ + H+ ②A
Ⅱ.⑴ <
⑵PbCl2
⑶10
Pb(OH)3— + OH— = Pb(OH)42—
本题解析:略
本题难度:一般
3、填空题 现有如图所示的转化关系,图中各物质均为常见物质,转化中有部分物质已省略。
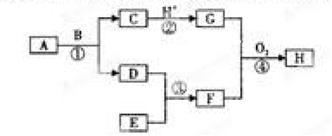
上述物质中C是一种黑色磁性固体,F是极易溶于水且水溶液呈碱性的气体,H是红褐色沉淀,A、D、E均为单质,请回答下列问题:
(1)写出下列物质的化学式:A: 、E
(2)写出④中生成H的非氧化还原反应的离子方程式:
(3)在120℃、1大气压下将168gA和90gB放入1L,密封烧瓶中发生反应①,经过10min达到平衡,平衡后D的质量为4g(固体体积忽略不计),则用D表示10min内的平均反应速率为 ,该温度下此反应的平衡常数K= ,B的转化率是 。
参考答案:(1)Fe(1分) N2(1分)
(2)Fe3++3NH3+H2O==Fe(OH)3↓+3NH4+(2分)
(3)V(H2)=0.2mol·L-1·min-1(2分) K=(2/3)4或2/3(3分) 40%(3分)
本题解析:由题意知,A为Fe,B为H2O,C为Fe3O4,D为H2,E为N2,F为NH3,H为Fe(OH)3。
(2)C为Fe3O4与H+反应后在G中即含有Fe3+又含有Fe2+,故生成H的非氧化还原反应只能是Fe3+生成Fe(OH)3。
(3)反应写出①:3Fe + 4H2O(g) = Fe3O4 + 4H2
开始 166g 90g
10min后 3mol 4g
转化 2mol 2mol
故V(H2)=" 2mol/1L/10min" = 0.2mol·L-1·min-1;
平衡常数K=c4(H2)/ c4(H2O) = (2/3)4;
B的转化率=2mol/5mol=40%。
考点:无机物的推断,化学反应速率、化学平衡常数、转化率的计算
本题难度:一般
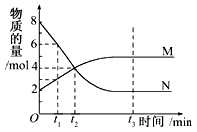
4、选择题 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图所示,下列表述中正确的是
[? ]
A.反应的化学方程式为:2M N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
参考答案:D
本题解析:
本题难度:一般
5、填空题 (12分)已知反应2HI(g)  H2(g) +I2(g)在T℃下的平衡常数为0.01。T℃时,在容积为2L的密闭容器中加入HI,反应到某时刻测得各组分的浓度如下:
H2(g) +I2(g)在T℃下的平衡常数为0.01。T℃时,在容积为2L的密闭容器中加入HI,反应到某时刻测得各组分的浓度如下:
物质
| HI
| H2
| I2
|
浓度/(mol·L-1)
| 0.40
| 0.60
| 0.60
|
请计算回答下列问题(写出计算过程,否则不得分):
(1)起始加入HI的物质的量 mol。
(2)达到平衡后HI的物质的量浓度 mol·L-1(请保留三位有效数字)。
(3)T℃时,在另一个体积一定的密闭容器中,将I2(g)与H2(g) 置于其中发生上述反应,若达到平衡时H2(g)与I2(g)的体积比为1∶4,计算平衡时HI的体积分数为 ,以及开始时H2(g)与I2(g)的体积比为 。
参考答案:21.(12分)(1)3.2mol(3分) (2)1.33 mol/L或1.34mol/L(3分)
(3)4/5或80%(3分) 11:14(3分)
本题解析:(1)利用三段式,2HI(g) H2(g)+ I2(g)
H2(g)+ I2(g)
开始浓度 1.6mol/L 0 0
转化浓度 1.2mol/L 0.60mol/L 0.60mol/L
某时刻浓度 0.40mol/L 0.60mol/L 0.60mol/L
平衡浓度 1.6-2x x x 起始加入HI的物质的量为1.6X2=3.2mol
(2)根据K=x2/(1.6-2x)2="0.01" 解得 x=2/15达到平衡后HI的物质的量浓度(1.6-4/15)÷2="1.33" mol/L;
(3)利用三段式,
2HI(g) H2(g)+ I2(g)
H2(g)+ I2(g)
开始浓度 0 a b
转化浓度 2x x x
平衡浓度 2x a-x b-x 解得(a-x)/(b-x)=1/4 (a-x)(b-x)/4x2=0.01,
解得a=11,b=14,平衡时HI的体积分数为80%,开始时H2(g)与I2(g)的体积比为11:14
考点:考查化学平衡的有关计算。
本题难度:一般