1、选择题 将0.6molA和0.5molB充入0.4L密闭容器中发生2A(g)+B(g)?mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2mol.又知5min内用E表示的平均反应速率为0.1mol?L-1?min-1,下列结论正确的是( )
A.A、B的转化率均为20%
B.m值为1
C.5min内用A表示的平均反应速率为0.1mol?L-1?min-1
D.平衡时混合物总物质的量为1mol
参考答案:v(D)=0.2mol0.4L5min=0.1mol?L-1?min-1,又知5min内用E表示的平均反应速率为0.1mol?L-1?min-1,
则v(D):c(E)=0.1mol?L-1?min-1:0.1mol?L-1?min-1=1:1,
反应速率之比等于化学计量数之比,则m=1,则
2A(g)+B(g) D(g)+E(g)
D(g)+E(g)
起始:0.6mol 0.5mol 0 0
转化:0.4mol 0.4mol 0.2mol0.2mol
平衡:0.2mol 0.1mol 0.2mol 0.2mol
A.A的转化率为0.4mol0.6mol×100%=33.3%,B的转化率为0.4mol0.5mol×100%=80%,故A错误;
B.由以上计算可知,D、E的反应速率相同,则m=1,故B正确;
C.v(A)=2v(D)=2×0.1mol?L-1?min-1=0.2mol?L-1?min-1,故C错误;
D.平衡时混合物总物质的量为0.2mol+0.1mol+0.2mol+0.2mol=0.7mol,故D错误.
故选B.
本题解析:
本题难度:一般
2、选择题 在一个容积为V L的密闭容器中放入2 L A(g)和1 L B(g),在一定条件下发生下列反应3A(g)十B(g) 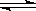 nC(g)+2D(g) ,达到平衡后,A物质的量浓度减小1/2,混合气体的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是
nC(g)+2D(g) ,达到平衡后,A物质的量浓度减小1/2,混合气体的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是
A.1
B.2
C.3
D.4
参考答案:A
本题解析:略
本题难度:一般
3、填空题 (8分) A(g)+2B(g)  2C(g)的反应中,时间t与C的体积分数(C%)的函数关
2C(g)的反应中,时间t与C的体积分数(C%)的函数关
系如图所示。回答下列问题:
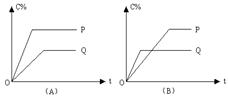
(1)图A中若两条曲线分别表示在100℃和400℃时的C%与时间t的函数关系,则P表示的温度为?℃,
从P、Q分析反应A(g)+2B(g)  2C(g)是?反应(填“吸热”或“放热”);
2C(g)是?反应(填“吸热”或“放热”);
(2)图B中P表示的温度为?℃,反应A(g)+2B(g)  2C(g)是?反应(填“吸热”或“放热”)。
2C(g)是?反应(填“吸热”或“放热”)。
参考答案:(1)400℃?吸热(2)100℃?放热
本题解析:(1)温度高,反应速率快,达到平衡的时间少,P曲线首先达到平衡状态,所以P表示400℃。温度高,C的含量也高,说明升高温度,平衡向正反应方向移动,所以正反应是吸热反应。
(2)根据图像可知,Q曲线首先达到平衡状态,所以Q表示的是400℃,因此P表示的是100℃。温度低,C的含量高,说明降低温度,平衡向正反应方向移动,所以正反应是放热反应。
本题难度:一般
4、选择题 据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实,其反应的化学方程式为:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) 。 下列叙述正确的是
CH3CH2OH(g)+3H2O(g) 。 下列叙述正确的是
A.当v(CO2)=2v(CH3CH2OH)时,反应一定达到平衡状态
B.当平衡向正方向移动时,平衡常数一定增大
C.增大压强,可提高CO2和H2的转化率
D.相同条件下,2 mol氢原子所具有的能量等于1 mol氢分子所具有的能量
参考答案:C
本题解析:A.当v(CO2)=2v(CH3CH2OH)时,没有说明方向问题,无法判断是否达到平衡状态,错误;B、平衡常数只与温度有关,温度不变,平衡常数就是定值;D、因为 2 mol氢原子生成1 mol氢分子过程中释放能量,所以前者的能量高于后者;
本题难度:一般
5、简答题 甲醇(CH3OH)可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+H2O(g)?CO2(g)+3H2(g)
一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后达到平衡,测得混合气体的压强是反应前的1.2倍.
(1)20s中用甲醇表示的该反应的平均速率为多少?
(2)甲醇的平衡转化率为多少?
参考答案:根据压强之比等于物质的量之比,故反应后混合气体总的物质的量=1.2×(1mol+3mol)=4.8mol,
令参加反应的甲醇的物质的量为xmol,则:
CH3OH(g)+H2O(g)?CO2(g)+3H2(g) 物质的量增大△n
1 2
xmol 4.8mol-4mol=0.8mol
故x=0.4mol
(1)v(CH3OH)=0.4mol2L20s=0.01mol/(L?s),
答:20s中用甲醇表示的该反应的平均速率为0.01mol/(L?s).
(2)甲醇的转化率=0.4mol1mol×100%=40%,
答:甲醇的转化率为40%.
本题解析:
本题难度:一般