1、选择题 在铁的电化学腐蚀中,发生还原反应的那个电极上进行的电极反应是( )
A.2H2O+O2+4e-═4OH-
B.2H++2e-═H2
C.4OH--4e-═2H2O+O2
D.Fe-2e-═Fe2+
参考答案:根据原电池工作原理,在铁的电化学腐蚀中,活泼的金属铁作负极,不如铁活泼的金属或导电的非金属作正极,所以铁作负极,正极上得电子发生还原反应,钢铁发生吸氧腐蚀时,正极上氧气得电子和水反应生成氢氧根离子,即2H2O+O2+4e-═4OH-,发生析氢腐蚀时,正极上是氢离子得电子的反应,即2H++2e-═H2,负极失电子变成离子进入溶液,即Fe-2e-=Fe2+.
故选AB.
本题解析:
本题难度:简单
2、选择题 如图所示装置中都盛有0.1 mol/L的NaCl溶液,放置一定时间后,装置中的四块相同锌片,腐蚀速率由快到慢的正确顺序是
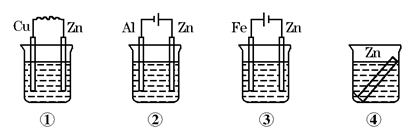
A.③①④②
B.①②④③
C.①②③④
D.②①④③
参考答案:D
本题解析:腐蚀快慢为:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀;装置①中锌作负极,发生电化学腐蚀,加快锌的腐蚀,装置②中锌作电解池阳极,在外加电源的作用下,锌的腐蚀速率更快,装置③中锌作电解池阴极,为阴极电保护法,不易被腐蚀,装置④中发生化学腐蚀,所以腐蚀速率由快到慢的顺序为②①④③,选D。
本题难度:一般
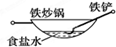
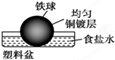
3、选择题 相同材质的铁在下图中的四种情况下最不易被腐蚀的是 ( )
 ?
? ?
? ?
?
A? B? C? D
参考答案:C
本题解析:A、铁做负极、铜做正极,食醋为电解质溶液,形成原电池,铁发生电化学腐蚀,故A不选;B、铁做负极、合金中的碳等材料做正极,食盐水为电解质溶液,形成原电池,铁发生电化学腐蚀,故B不选;C、铁被均匀的铜镀层保护,不易被腐蚀,故C正确;D、铁做负极、铜做正极,酸雨为电解质溶液,形成原电池,铁发生电化学腐蚀,故D不选,故选C。
本题难度:一般
4、选择题 下图所示烧杯中均盛有海水,锌在其中被腐蚀的速率最慢的是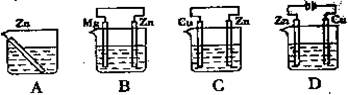
参考答案:B
本题解析:A、根据装置可知A装置是锌的化学腐蚀,A不正确;B、B装置是原电池,其中镁的金属性强于锌,因此镁是负极,失去电子被腐蚀。锌是正极被保护,属于牺牲阳极的阴极保护法,B正确;C、C装置也是原电池,其中锌的金属性强于铜,锌是负极失去电子,被腐蚀,C不正确;D、D装置是电解池,锌与电源的正极相连,做阳极失去电子加快腐蚀,D不正确,答案选B。
本题难度:一般
5、选择题 被称为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内的离子“流过”水和氧化锌组成的电解液。总反应的化学方程式为:Zn+2MnO2+H2O=Zn(OH)2+Mn2O3,下列说法错误的是(?)
A.电池工作时,锌失去电子
B.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g
C.电池工作时,电子由正极通过外电路流向负极
D.电池正极的电极反应式为:2MnO2+H2O+2e-= Mn2O3+2OH-
参考答案:C
本题解析:在纸质电池中镀锌一边为负极,镀二氧化锰一边为正极。电池工作时A.电池工作时,锌失去电子产生的Zn2+与OH-结合产生Zn(OH)2。正确。B.由方程式可看出:1摩尔Zn反应,转移电子2摩尔。即外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g。正确。C电池工作时,电子由负极通过外电路流向正极。错误。D.电池正极的电极反应式为:2MnO2+H2O+2e-= Mn2O3+2OH-,负极的电极反应式为:Zn-2e-+2OH -= Zn(OH)2.正确。
本题难度:一般