|
|
|
高考化学知识点总结《气体的净化、干燥、吸收与收集》高频考点特训(2017年练习版)(一)
2017-11-11 03:38:34
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、实验题 实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
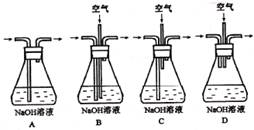
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为:_?;为了吸收该反应中产生的尾气,应选择下列装置(填字母)。
(2)为符合绿色化学的要求,某研究性学习小组设计了如下两种方案:
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通人到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp(Cu(OH)2]=10-22, Ksp[Fe(OH)2]=10-16,Ksp[Fe(OH)3]=10-38
请回答下列问题:
①方案1中的B仪器名称是_。
②为了使铁元素全部沉淀,应调节pH至少为_。
③方案2中甲物质可选用的是_。
A.CaO
B.NaOH
C.CuCO3
D.Cu2(OH)2CO3 E. Fe2(SO4)3
| ④反应中加人少量FeSO4可加速铜的氧化,用离子方程式解释其原因?、
?
2、实验题 下列装置为中学化学实验常用的气体制备装置
 ? ? ? ?
A? B? C
(1)若用NaHCO3和稀盐酸制取二氧化碳,应选择装置 ?。
(2)若用NH4Cl和碱石灰制取NH3,应选择装置 ?。
(3)若用高锰酸钾和浓盐酸不加热制取Cl2,应选择装置?。
(4)①某研究性小组查阅资料得知,漂白粉与硫酸溶液反应可制的氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4="2" CaSO4+2 Cl2+2H2O应选择装置?。
②为证明氯气具有氧化性将氯气分别通入到亚硫酸钠溶液和氯化亚铁溶液中,设计实验证明亚硫酸钠已经被氧化 ?。
写出氯气和氯化亚铁溶液反应的离子方程式:?。
③请写出氯气尾气处理的离子方程式 ??。
3、实验题 (18分)某同学设计如图所示装置分别进行探究实验(夹持装置已略去)
实验
| 药品
| 制取气体
| 量气管中的液体
| ①
| Cu、稀HNO3
| ?
| H2O
| ②
| NaOH固体、浓氨水
| NH3
| ?
| ③
| Na2CO3固体、稀H2SO4
| CO2
| ?
| ④
| 镁铝合金、NaOH溶液(足量)
| H2
| H2O
|
?
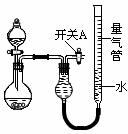
请回答下列问题:
(1)简述如何检查该装置的气密性: 。
(2)该同学认为实验①可通过收集测量NO气体的体积,来探究Cu样品的纯度。你认为是否可行?请简述原因。 。
( 3)实验②中剩余的NH3需吸收处理。以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有? 3)实验②中剩余的NH3需吸收处理。以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有?
、(4)实验③中,量气管中的液体最好是 。
A.H2O
B.CCl4
C.饱和Na2CO3溶液
D.饱和NaHCO3溶液
|
(5)本实验应对量气管多次读数,读数时应注意:
①恢复至室温,②
,③视线与凹液面最低处相平。
(6)实验④获得以下数据(所有气体体积均已换算成标准状况)
编号
| 镁铝合金质量
| 量气管第一次读数
| 量气管第二次读数
|
①[
| 1.0g
| 10.0mL
| 346.3mL
|
②
| 1.0g
| 10.0mL
| 335.0mL
|
③
| 1.0g
| 10.0mL
| 345.7mL
|
根据上述
合理数据计算镁铝合金中铝的质量分数
。
4、选择题 下列气体中,既可用浓硫酸干燥,又可用固体氢氧化钠干燥的是
A.Cl2
B.SO2
C.H2
D.NH3
5、选择题 括号内物质为杂质,下列除去杂质的做法不正确的是
A.乙酸乙酯(乙酸和乙醇):用饱和Na2CO3溶液洗涤后分液
B.乙烷(乙烯):用浓溴水洗气
C.乙醇(乙酸):用NaOH溶液中和后分液
D.乙醇(水):用生石灰吸水后蒸馏

 3)实验②中剩余的NH3需吸收处理。以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有?
3)实验②中剩余的NH3需吸收处理。以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有?





