1、选择题 关于二氧化硫和二氧化氮叙述正确的是
A.两种气体都是无色有毒的气体,且都可用水吸收以消除对空气的污染
B.二氧化硫与过量的二氧化氮混合后通入水中能得到两种常用的强酸
C.两种气体都具有强氧化性,因此都能够使品红溶液褪色
D.两种气体溶于水都可以与水反应,且只生成相应的酸
参考答案:B
本题解析:略
本题难度:简单
2、选择题 常温下,由下列实验事实得出结论错误的是
A.SO2使品红溶液和溴水褪色,说明SO2具有漂白性
B.BaSO4不溶于水和酸,在医学上可用作钡餐
C.洒落在地上的汞可在其表面撒硫磺除去
D.蔗糖加入浓硫酸后变黑,说明浓硫酸具有脱水性
参考答案:A
本题解析:SO2使品红溶液是因为其漂泊性,但使溴水褪色,则是因为其还原性,被溴水氧化导致,所以答案是A。
本题难度:一般
3、选择题 基于实验现象的推论,你认为合理的是(?)
选项
| 实验现象
| 推论
|
A
| 乙烯气体可以使溴水褪色
| 乙烯发生取代反应
|
B
| 浓硫酸电导率比较低
| 硫酸浓度大时是弱电解质
|
C
| 氨气用于喷泉实验
| 氨气极易溶于水
|
D
| 硝酸溶液使pH试纸先变红后变白
| 硝酸酸性太强不能用pH试纸检测
参考答案:C
本题解析:A. 乙烯气体可以使溴水褪色是因为发生了加成反应。错误。B.浓硫酸电导率比较低是因为在浓硫酸中硫酸主要以分子的形式存在,其中含有的自由移动的离子浓度较小。错误。C。氨气用于喷泉实验,是因为氨气在水中溶解度很大,氨气极易溶于水。1:700。当氨气在水中溶解,使烧瓶中的气体压强小于外界大气压强,水在大气压强的作用下,进入烧瓶,继续溶解氨气,再形成压强差。喷泉就此形成。正确。D.硝酸溶液使pH试纸先变红后变白,是因为硝酸有酸性,能够电离产生H+使pH试纸变红,但是由于硝酸有强氧化性,会把变红色的pH氧化为无色物质,因而又变为无色。错误。
本题难度:一般
4、选择题 下列物质加入溴水,经振荡,不因发生化学反应而使溴水褪色的是
[? ]
A.Na2S
B.NaOH
C.甲苯
D.裂化汽油
参考答案:C
本题解析:
本题难度:简单
5、实验题 为探究铜与浓硫酸的反应,甲、乙两同学分别设计了图1、图2所示装置,将足量铜和10 mL 18 mol·L-1浓硫酸共热,直到无气体生成为止(假定反应前后试管中溶液的体积不变)。
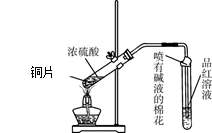 ? ?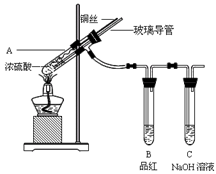
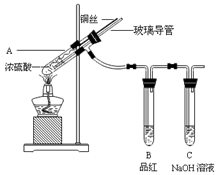 图1?图2 图1?图2
(1)比较两实验装置,图2装置的优点是:①?;②?。
(2)①甲根据所学的化学知识认为还有一定量的硫酸剩余。甲认为硫酸剩余的理论依据是?。
②下列药品中能够用来证明反应结束后的烧瓶中确有硫酸剩余的是_______。(选填编号)
A.过量铁粉
B.氯化钡溶液
C.银粉
D.碳酸氢钠溶液
|
(3)乙在拆除图2装置前,不打开胶塞,为使装置中的残留气体完全被吸收,应当采取的操作是?。
(4)为定量测定当剩余硫酸浓度不大于何值时,铜与硫酸就不能反应,甲、乙两位同学进行了如下设计:
①甲方案:将产生的气体缓缓通过预先称量过的盛有?的干燥管,反应结束后再次称量,干燥管质量增加m g。其余酸浓度为?mol·L-1。
②乙方案:分离出反应后的溶液并加蒸馏水稀释至1 000 mL,取20.00 mL于锥形瓶中,滴入2~3滴?,(选填“酚酞”、“甲基橙”)用0.1000mol·L-1标准NaOH溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),用去NaOH溶液V mL。其余酸浓度为?mol·L-1。
③甲、乙两方案比较,你认为误差较大的是?,理由是?。
参考答案:
(1)①能更好地吸收有毒气体SO2,防止其污染环境
②停止加热时,能防止倒吸或平衡压强
③通过铜丝的上下抽动可以控制反应的发生和停止 。
(2)①随着反应的进行,浓硫酸会变成稀硫酸,而稀硫酸不与铜反应。
②A D
(3)从导管口向A中大量鼓气 。
(4)①碱石灰;? [18-25m/8]?。
②甲基橙;? 0.25v 。
③甲;?被碱石灰吸收的除了SO2外还有水蒸气,导致SO2的质量偏大,计算出的余酸浓度偏小。
本题解析:
(1)比较两实验装置,图2装置的优点是:①通过铜丝的上下抽动可以使反应随时发生,也可以是反应随时停止,这样就可以控制化学反应的进行;②用品红溶液检验后用NaOH来吸收SO2,可以减少有毒气体的排放,更环保。③由于在图2装置中有一根玻璃导管。当停止加热时,它能平衡压强,这样就可以防止倒吸现象的发生。
(2)①Cu与浓硫酸发生反应:Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O随着反应的进行,浓硫酸会变成稀硫酸,而稀硫酸不与铜反应。因此还有一定量的硫酸剩余。②A、若有硫酸剩余,则加入Fe粉时会发生反应:Fe+H2SO4=FeSO4+H2↑。冒气泡。正确。B.无论是否有硫酸剩余,在溶液中都含有SO42-,加入氯化钡溶液时发生反应:Ba2++ SO42-=BaSO4↓。产生白色沉淀。错误。C. 在金属活动性顺序表中Ag在H的后面,不能把酸中的H置换出来。错误。D.酸性H2SO4 >H2CO3,所以加入碳酸氢钠溶液时发生反应H2SO4+ 2NaHCO3=Na2SO4+2H2O+2CO2↑。冒气泡。正确。故正确选项为A 、D。
CuSO4+SO2↑+2H2O随着反应的进行,浓硫酸会变成稀硫酸,而稀硫酸不与铜反应。因此还有一定量的硫酸剩余。②A、若有硫酸剩余,则加入Fe粉时会发生反应:Fe+H2SO4=FeSO4+H2↑。冒气泡。正确。B.无论是否有硫酸剩余,在溶液中都含有SO42-,加入氯化钡溶液时发生反应:Ba2++ SO42-=BaSO4↓。产生白色沉淀。错误。C. 在金属活动性顺序表中Ag在H的后面,不能把酸中的H置换出来。错误。D.酸性H2SO4 >H2CO3,所以加入碳酸氢钠溶液时发生反应H2SO4+ 2NaHCO3=Na2SO4+2H2O+2CO2↑。冒气泡。正确。故正确选项为A 、D。
(3)乙在拆除图2装置前,不打开胶塞,为使装置中的残留气体完全被吸收,应当采取的操作是从导管口向A中大量鼓气 。
(4)①由于SO2是酸性气体,能与碱发生反应,所以在甲方案:将产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,反应结束后再次称量,干燥管质量增加m g。n(SO2)=(64/m)mol,反应消耗的硫酸的物质的量为(32/m)mol.剩余的硫酸物质的量浓度为{18×10-2mol-(32/m)mol}÷10-2L=(18-25m/8)mol/L。
②乙方案:由于氢氧化铜开始沉淀的pH约为5甲基橙的变色范围为3.1~4.4.酚酞的变色范围是8.2~10.所以为了减少实验误差,在酸碱中和滴定时选择的指示剂为甲基橙。此时只发生酸碱中和反应。取20.00 mL稀释后的溶液。用0.1000mol/L标准NaOH溶液进行滴定用去NaOH溶液V mL。n(NaOH)= V×10-4mol.剩余硫酸的物质的量为n(H2SO4)= 5V×10-5mol,所以其余酸浓度为(1 000 mL÷20.00 mL) 5V×10-5mol ÷0.01L=0.25v mol/L。 ?
③甲、乙两方案比较,误差较大的是甲;因为该反应发生时产生的SO2气体中含有水蒸气,被碱石灰吸收的除了SO2外还有水蒸气,导致SO2的质量偏大,则计算出的余酸浓度偏小。
本题难度:困难