1、选择题 下图中,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色、无臭气体放出,符合这一情况的是

[? ]
a电极?
?b电极
X电极
溶液
A.
锌?
石墨
负极
CuSO4
B.
石墨?
石墨
负极
NaOH
C.
银?
铁
正极
AgNO3
D.
铜
石墨
负极
CuCl2
参考答案:A
本题解析:
本题难度:一般
2、选择题 用铂电极电解一定质量某浓度的CuSO4,一段时间后停止电解。若此时加入19.6gCu(OH)2,所得溶液恰好与原溶液完全相同,则下列说法不正确的是
A.原溶液中溶质的质量为32g
B.电解过程中转移电子的物质的量为0.8mol
C.电解过程中阳极产生的气体在标准状况下的体积为4.48L
D.在相同条件下,阴极得到气体的体积大于阳极得到气体的体积
参考答案:D
本题解析:本题分两个阶段,先是电解CuSO4溶液,再是电解水。两极得到气体的体积相等
本题难度:简单
3、选择题 用铁作电极,电解500mL 1mol/L CuSO4溶液,当某电极质量增加19.2g时,停止通电。将溶液转移至蒸发皿中,蒸干灼烧,得到固体质量为
A.77.6 g
B.80g
C.92 g
D.82.7 g
参考答案:A
本题解析:通电后发生反应有,阳极:Fe-2e-=Fe2+;阴极:Cu2++2e-=Cu?
电极质量增加全为Cu,m(Cu)=19.2g,即n(Cu)=0.3mol
将溶液蒸干灼烧,得到固体为FeSO4、CuSO4,其中n(FeSO4)=0.3mol,
n(CuSO4)=500mL ×1mol/L-0.3mol=0.2mol,m总=0.3mol×152g/mol+0.2mol×160g/mol=77.6g
点评:本题以电解为背景,涉及到了化学物质的量的简单计算,学生要熟练掌握电解的电极反应,这是解题的前提。
本题难度:简单
4、填空题 如图所示,若电解5 min 时铜电极质量增加2.16 g,试讨论:
时铜电极质量增加2.16 g,试讨论:
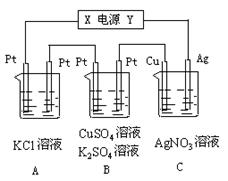
⑴电源电极X名称为_________。
⑵ pH变化:A_______,B______,C______。
⑶通过5 min时,B中共收集224 mL气体(标况),溶液体积为200mL,则通电前硫酸铜溶液的物质的量浓度为______________。
⑷若A中KCl溶液的体积也是2 00 mL,且电解过程中体积不变,电解后溶液中的氢氧根离子浓度是__________
00 mL,且电解过程中体积不变,电解后溶液中的氢氧根离子浓度是__________ 。
。
参考答案:负,增大,减小,不变(3)0.025mol/L (4)0.1mol/L
本题解析:略
本题难度:一般
5、选择题 在外界提供相同电量的条件下,Cu2+或Ag+分别按Cu2++2e-="Cu" 或Ag++e-=Ag在电极上放电,若析出铜的质量为1.92g,则析出银的质量为 ( )
A.12.96g
B.3.24g
C.6.48g
D.1.62g
参考答案:C
本题解析:析出铜的物质的量是1.92g÷64g/mol=0.03mol,转移电子的物质的量是0.03mol×2=0.06mol,则关键电子守恒可知,析出银的物质的量是0.06mol,质量是0.06mol×108g/mol=6.48g,答案选C。
考点:考查电解池中电极产物的有关计算
点评:该题是高考中的常见考点,难度不大。明确电子守恒是解题的关键,有利于培养学生的逻辑推理能力和规范答题能力。
本题难度:简单