1、选择题 下列事实不能用平衡移动原理加以解释的是(?)
A.升高温度促进SO2转化为SO3
B.在反应2SO2+O2 2SO3中,增加O2可提高SO2的转化率
2SO3中,增加O2可提高SO2的转化率
C.可用浓NH3·H2O和烧碱固体快速制NH3
D.加压有利于SO2和O2反应生成SO3
参考答案:A
本题解析:SO2→SO3是一个放热反应,升高温度使SO3转化为SO2。
本题难度:简单
2、选择题 在一体积固定容器内,对于N2(g)+3H2(g) 2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为( )
2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为( )
A.断开1个N≡N键的同时有6个N—H键生成
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.N2、H2、NH3分子数之比1∶3∶2的状态
参考答案:C
本题解析:可逆反应达到化学平衡状态的实质是正逆反应速率相等但不为0。会生成断开1个N≡N键的同时,必然会生成2分子氨气,即6个N—H键生成,A不正确。密度是气体的质量和容器体积的比值,反应前后气体质量和容器体积均不变,所以在任何时刻混合气体的密度不变,B不正确。混合气体的平均相对分子质量是混合气的质量和混合气的物质的量的比值,质量不变,但物质的量是变化的,所以C可以说明。N2、H2、NH3分子数之比1∶3∶2的状态不一定满足正逆反应速率相等,D不正确。答案选C。
本题难度:简单
3、填空题 (18分)能源的开发和利用是当前科学研究的重要课题。
(1)利用二氧化铈(CeO2)在太阳能作用下前实现如下变废为宝的过程:
mCeO2 ?(m-x)CeO2
?(m-x)CeO2 xCe+xO2
xCe+xO2
(m-x)CeO2 xCe+xH2O+xCO2
xCe+xH2O+xCO2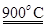 mCeO2+xH2+xCO
mCeO2+xH2+xCO
上述过程的总反应是?,该反应将太阳能转化为?。
(2)CO、O2和KOH溶液构成的燃料电池的负极电极反应式为?。该电池反应可获得K2CO3溶液,某温度下0.5mol L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O
L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O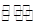 HCO3-+OH-的平衡常熟Kh= ?。
HCO3-+OH-的平衡常熟Kh= ?。
(3)氯碱工业是高耗能产业,下列将电解池与燃料电池相组合的工艺可以节能30%以上。

①电解过程中发生反应的离子方程式是?,阴极附近溶液PH?(填“不变”、“升高”或“下降”)。
②如果粗盐中SO42-含量较高,精制过程需添加钡试剂除去SO42-,该钡试剂可选用下列试剂中的?。
a.Ba(OH)2 ?b.Ba(NO3)2? c.BaCl2
现代工艺中更多使用BaCO3除SO42-,请写出发生反应的离子方程式?。
③图中氢氧化钠溶液的质量分数a%?b%(填“>”、‘‘=”或“<”),,燃料电池中负极上发生的电极反应为?。
参考答案:(18分)
(1)H2O + CO2 =H2 + CO + O2(2分)?化学能(1分)
(2)CO – 2e- +4OH- = CO32- + 2H2O(2分)? 2×10-4 mol·L-1(2分)
(3)①2Cl-+2H2O  ?Cl2↑+ H2↑+2OH-(2分)?升高(1分)?
?Cl2↑+ H2↑+2OH-(2分)?升高(1分)?
②? ac(2分)? BaCO3(s)+ SO42-(aq) = BaSO4 (s)+ CO32-(aq)(2分)
③? <(2分)? H2-2e-+2OH-=2H2O?(2分)
本题解析:(1)两式相加可得总反应方程式:H2O + CO2 =H2 + CO + O2;通过该反应把太阳能转化为了化学能。
(2)在碱性条件下,CO失电子转化为CO32?,电解方程式为:CO – 2e- +4OH- = CO32- + 2H2O;溶液的pH=12,则c(OH?)=0.01mol?L?1,若忽略CO32-的第二级水解,c(HCO3?)=0.01mol?L?1,则Kh=c(HCO3?)?c(OH?)/c(CO32?)= 0.01mol?L?1×0.01mol?L?1/0.5mol?L?1= 2×10-4 mol·L-1。
(3)①电解食盐水生成H2、H2和NaOH,所以离子方程式为:2Cl-+2H2O  ?Cl2↑+ H2↑+2OH-;阴极上H2O电离出的H+得电子生成H2,使H2O的电离平衡向右移动,OH?浓度增大,所以pH升高。
?Cl2↑+ H2↑+2OH-;阴极上H2O电离出的H+得电子生成H2,使H2O的电离平衡向右移动,OH?浓度增大,所以pH升高。
②Ba(OH)2可与SO42?反应,OH?可加盐酸除去,BaCl2可与SO42?反应,而且不引入新杂质,Ba(NO3)2能与SO42?反应,但NO3?无法除去,故ac正确;BaCO3转化为更难溶的BaSO4,离子方程式为:BaCO3(s)+ SO42-(aq) = BaSO4 (s)+ CO32-(aq)。
③在燃料电池中,氧气作正极,所以通入空气的极是正极,O2得电子生成OH?,通入燃料的电极是负极,消耗OH?,所以a% < b%;负极是燃料氢气发生失电子的氧化反应,电极反应式为H2-2e-+2OH-=2H2O。
本题难度:一般
4、计算题 (6分)PCl5的热分解反应如下:PCl5(g)  ?PCl3(g) + Cl2(g)。
?PCl3(g) + Cl2(g)。
(1)写出反应的平衡常数表达式;
(2)已知某温度下,在容积为10.0L的密闭容器中充入2.00mol PCl5,达到平衡后,测得容器内PCl3的浓度为0.150mol/L。求该温度下的平衡常数。
(3)在相同的容器中起始充入5.00mol PCl5,达平衡后, PCl5的分解率是多少?
参考答案:(1)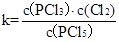 ?(2)K=0.45?(3)60%
?(2)K=0.45?(3)60%
本题解析:(1)平衡常数是在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度幂之积的比值,所以表达式为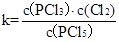 。
。
(2)? PCl5(g)  ?PCl3(g) + Cl2(g)
?PCl3(g) + Cl2(g)
起始浓度(mol/lL)? 0.2? 0? 0
转化浓度(mol/l)? 0.15? 0.15? 0.15
平衡浓度(mol/L0? 0.05? 0.15? 0.15
所以K=
(3)? PCl5(g)  ?PCl3(g) + Cl2(g)
?PCl3(g) + Cl2(g)
起始浓度(mol/lL)? 0.5? 0? 0
转化浓度(mol/l)? x? x? x
平衡浓度(mol/L0? 0.5-x? x? x
所以K=
解得x=0.3
所以转化率是0.3÷0.5×100%=60%
本题难度:一般
5、选择题 反应:L(s)+aG(g)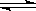 bR(g)?达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断(?)
bR(g)?达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断(?)

A.上述反应 △H<0
B.上述反应△H>0
C.a>b
D.a<b
参考答案:BD
本题解析:反应:L(s)+aG(g)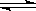 bR(g) 图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数,看等温线,随着压强增大,平衡向体积减小的方向移动,G的体积分数减小,说明平衡向正反应方向移动,即a<b;看等压线p1或p2,随着温度升高,平衡向吸热方向移动,G的体积分数减小,说明平衡向正反应方向移动,即△H>0,故选B D。
bR(g) 图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数,看等温线,随着压强增大,平衡向体积减小的方向移动,G的体积分数减小,说明平衡向正反应方向移动,即a<b;看等压线p1或p2,随着温度升高,平衡向吸热方向移动,G的体积分数减小,说明平衡向正反应方向移动,即△H>0,故选B D。
点评:在此总结一下对于化学平衡的有关图象问题的分析方法:
(1)认清坐标系,搞清纵、横坐标所代表的意义,并与勒夏特列原理挂钩。
(2)紧扣可逆反应的特征,看清正反应方向是吸热还是放热、体积增大还是减小、不变、有无固体、纯液体物质参加或生成等。
(3)看清速率的变化及变化量的大小,在条件与变化之间搭桥。
(4)看清起点、拐点、终点,看清曲线的变化趋势。
(5)先拐先平,数值大。例如,在转化率一时间图上,先出现拐点的曲线先达到平衡,此时逆向推理可得该变化的温度高、浓度大、压强高。
(6)定一议二。当图象中有三个量时,先确定一个量不变再讨论另外两个量的关系
本题难度:简单