1、选择题 下列变化中没有发生氧化还原反应的是
A.金属冶炼
B.SO2使品红溶液褪色
C.钢铁锈蚀
D.食物腐败
参考答案:B
本题解析:A.金属冶炼是把金属从化合物中还原出来,是氧化还原反应,错误;B.SO2使品红溶液褪色发生的是化合反应,因为在反应前后元素的化合价没变,所以不是氧化还原反应,正确;C.钢铁锈蚀是铁的单质变为氧化物,有元素的化合价的变化,是氧化还原反应,错误;D.食物腐败是食物的缓慢氧化反应,属于氧化还原反应,错误。
本题难度:一般
2、填空题 (19分) (1)利用H2S废气制取氢气的方法有多种。
①高温热分解法:已知:H2S(g)  H2(g)+1/2S2(g)ΔH在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol/L测定H2S的转化率,结果见图。
H2(g)+1/2S2(g)ΔH在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol/L测定H2S的转化率,结果见图。
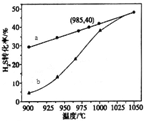
图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。ΔH_____0(填>,=或<):说明随温度的升高,曲线b向曲线a靠近的原因:________________________。
②电化学法:该法制氢过程的示意图如图。

反应池中反应的离子方程式是_____________________________;
反应后的溶液进入电解池,电解总反应的离子方程式为___________________________________。
(2)以Al和NiO(OH)为电极,NaOH溶液为电解液可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。
①该电池的负极反应式__________________。②电池总反应的化学方程式__________________。
(3)某亚硝酸钠固体中可能含有碳酸钠和氢氧化钠,现测定亚硝酸钠的含量。
已知:5NaNO2+2KMnO4+3H2SO4=5NaNO3+2MnSO4+K2SO4+3H2O
称取4.000g固体,溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L,酸性KMnO4溶液进行滴定,实验所得数据如下表所示;
滴定次数
| 1
| 2
| 3
| 4
|
KMnO4溶液的体积/ml
| 20.60
| 20.02
| 20.00
| 19.98
|
①滴入最后一滴酸性KMnO4溶液,溶液___________,30秒内不恢复,可判断达到滴定终点。
②第一组实验数据出现异常,造成这种异常的原因可能是____________(填序号)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗;
B.锥形瓶洗净后未干燥;
C.滴定终了仰视读数
③根据表中数据,计算所得固体中亚硝酸钠的质量分数_____________。
参考答案:(19分)(1) ① >(2分),温度升高,反应速率加快,达到平衡所需的时间缩短(或温度升高,反应速率加快,相同时间内更快达到平衡) (2分)
②2Fe3+ + H2S==2Fe2++S↓+2H+(2分)2Fe2+ + 2H+ 2Fe3++H2↑(2分)
2Fe3++H2↑(2分)
(2)①Al-3e- + 4OH-==AlO2-+2H2O (2分)
②Al+3NiO(OH)+NaOH+3H2O="Na" AlO2+3Ni(OH)2 (2分)
(3)①由无色变为紫红色(2分);②A、C (2分;③86.25%(3分);
本题解析:(1) ①根据图像a可知:升高温度,H2S的平衡转化率增大,说明升高温度,平衡正向移动,正反应方向是吸热反应,所以ΔH>0;随温度的升高,曲线b向曲线a靠近的原因是温度升高,反应速率加快,达到平衡所需的时间缩短,所以曲线b向曲线a靠近;②根据图示可知:在反应池中反应的离子方程式是2Fe3+ + H2S="=" 2Fe2++S↓+2H+;反应后的溶液中含有FeCl2、HCl把它们加入进电解池,由于阳离子放电能力:H+>Fe2+,所以在阴极发生反应:2H++2e-=H2↑;离子的放电能力:Fe2+>Cl->OH-,所以在阳极发生反应:2Fe2+-2e-= 2Fe3+↑;电解总反应的离子方程式为2Fe2+ + 2H+ 2Fe3++H2↑;(2) ①以Al和NiO(OH)为电极,NaOH溶液为电解液可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。由于活动性:Al> NiO(OH),所以Al为负极,该电池的负极反应式是Al-3e-+ 4OH-=AlO2-+2H2O;②电池总反应的化学方程式是Al+3NiO(OH)+NaOH+3H2O="Na" AlO2+3Ni(OH)2 ;(3) ①NaNO2有还原性,KMnO4有氧化性,二者会发生氧化还原反应而使酸性KMnO4溶液的紫色褪去,因此滴入最后一滴酸性KMnO4溶液,溶液由无色变为紫红色,半分钟内不褪色,可判断达到滴定终点。②A.酸式滴定管用蒸馏水洗净后未用标准液润洗;则同样的还原剂消耗的KMnO4溶液体积偏大,正确;B.锥形瓶洗净后未干燥,由于反应物的物质的量不变,所以对测定的物质浓度不产生影响,错误;C.滴定终了仰视读数,会是消耗的氧化剂的溶液体积偏大,正确;③根据表中数据,可知第一次误差太大,舍去,V(KMnO4)= (20.02+20.00+19.98)÷3=20.00ml;n(KMnO4)= V(KMnO4)×0.1000mol/L=" 0.02L" × 0.1000mol/L=2×10-3mol,则根据方程式中物质之间的物质的量关系可知n(NaNO2)=5/2n(KMnO4)= 5×10-3mol,所以所得固体中亚硝酸钠的质量分数是[(5×10-3mol×69g/mol) ×10]÷4.000g =3.450g÷ 4.000g=86.25%。
2Fe3++H2↑;(2) ①以Al和NiO(OH)为电极,NaOH溶液为电解液可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。由于活动性:Al> NiO(OH),所以Al为负极,该电池的负极反应式是Al-3e-+ 4OH-=AlO2-+2H2O;②电池总反应的化学方程式是Al+3NiO(OH)+NaOH+3H2O="Na" AlO2+3Ni(OH)2 ;(3) ①NaNO2有还原性,KMnO4有氧化性,二者会发生氧化还原反应而使酸性KMnO4溶液的紫色褪去,因此滴入最后一滴酸性KMnO4溶液,溶液由无色变为紫红色,半分钟内不褪色,可判断达到滴定终点。②A.酸式滴定管用蒸馏水洗净后未用标准液润洗;则同样的还原剂消耗的KMnO4溶液体积偏大,正确;B.锥形瓶洗净后未干燥,由于反应物的物质的量不变,所以对测定的物质浓度不产生影响,错误;C.滴定终了仰视读数,会是消耗的氧化剂的溶液体积偏大,正确;③根据表中数据,可知第一次误差太大,舍去,V(KMnO4)= (20.02+20.00+19.98)÷3=20.00ml;n(KMnO4)= V(KMnO4)×0.1000mol/L=" 0.02L" × 0.1000mol/L=2×10-3mol,则根据方程式中物质之间的物质的量关系可知n(NaNO2)=5/2n(KMnO4)= 5×10-3mol,所以所得固体中亚硝酸钠的质量分数是[(5×10-3mol×69g/mol) ×10]÷4.000g =3.450g÷ 4.000g=86.25%。
考点:考查温度与化学反应速率、化学平衡的关系、原电池和电解池的反应原理的应用、电极反应式的书写、滴定终点的判断、误差分析、滴定法在物质含量测定的应用的知识。
本题难度:困难
3、选择题 下列化学用语或命名正确的是
A.S2-的结构示意图: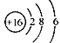
B.NH4Cl的电子式: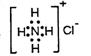
C.丙烯的实验式(最简式):CH2
D. 的名称:2-乙基丙烷
的名称:2-乙基丙烷
参考答案:C
本题解析:S2-的最外层电子为8电子 ; NH4Cl的电子式:
; NH4Cl的电子式: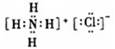 ;
; 的名称为2-甲基丁烷,故答案为C
的名称为2-甲基丁烷,故答案为C
本题难度:一般
4、选择题 下列有关化学用语书写正确的是
①蔗糖的最简式是CH2O?②次氯酸的结构式:H—Cl—O
③苯甲醇的结构简式: -CH2OH?④甲烷分子的比例模型:
-CH2OH?④甲烷分子的比例模型:
⑤S2-的电子排布图为:1s22s22p63s23p6?⑥原子核内有10个中子的氧离子: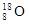 2-
2-
A.②③⑥
B.③⑥
C.①③⑤⑥
D.①②③④⑤⑥
参考答案:B
本题解析:①蔗糖的最简式是C12H22O11?②次氯酸的结构式为:H—O—Cl
③正确?④题目所示为甲烷分子的球棍模型:
⑤S2-的电子排布图为:1s22s22p63s23p8?⑥正确
答案为B
本题难度:简单
5、选择题 在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,每摩尔CuSO4能氧化P的物质的量为( )
A.1/5 mol
B.2/5 mol
C.3/5mol
D.11/5 mol