1、填空题 (3分)工业上冶炼金属铁的主要反应为:Fe2O3 + xCO 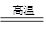 2Fe + 3CO2
2Fe + 3CO2
其中该化学方程式中x的数值是 , CO作 (填“氧化剂”或“还原剂”)。在该反应中,若消耗了1 mol Fe2O3,则生成 mol Fe。
参考答案:3,还原剂,2
本题解析:根据原子守恒可知,x=3;根据方程式可知,碳元素的化合价从+2价升高到+4价,失去电子,所以CO是还原剂;根据铁元素守恒可知,如果消耗了1 mol Fe2O3,则生成2mol单质铁。
考点:考查氧化还原反应的有关判断
点评:氧化还原反应的有关判断关键是准确判断元素化合价的变化。
本题难度:一般
2、选择题 下列化学用语正确的是
A.K+离子的结构示意图: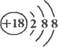
B.四氯化碳的电子式:
C.H4分子的比例模型: 
D.次氯酸的结构式: H-O-Cl
参考答案:D
本题解析:A、钾的核电荷数为19,故离子结构示意图中圆圈内的数字为19,故A错误;B、氯原子最外层电子没写出,故错误;C、该模型为球棍模型,不是比例模型,故错误;故选D。
本题难度:一般
3、选择题 下列电子式正确的是
A.H2O2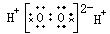
B.CCl4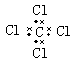
C.MgCl2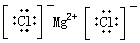
D.NaOH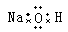
参考答案:C
本题解析:双氧水是共价化合物,电子式为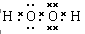 。四氯化碳中氯原子还有没有参与成键到电子,电子式为
。四氯化碳中氯原子还有没有参与成键到电子,电子式为 。氢氧化钠是离子化合物,电子式为
。氢氧化钠是离子化合物,电子式为 。所以正确的答案是C。
。所以正确的答案是C。
本题难度:简单
4、选择题 下列粒子不具有氧化性的是
A.ClO-
B.MnO4-
C.SO32-
D.S2-
参考答案:D
本题解析:氧化性在反应中得到电子,化合价降低,据此可以判断。A、ClO-中氯元素的化合价是+1价,可以得到电子,表现出氧化性,A不符合题意;B、MnO4-中Mn的化合价是+7价,可以得到电子,表现出氧化性,B不符合题意;C、SO32-中S元素的化合价是+4价,可以得到电子,表现出氧化性,C不符合题意;D、S2-中S元素的化合价是-2价,在反应中只能失去电子,表现出还原性,不能表现出氧化性,D正确,答案选D。
本题难度:一般
5、选择题 质量分数为W的NaOH溶液,其物质的量浓度为a,如热蒸发水分使其质量分数变为2W,此时该溶液中NaOH的物质量浓度为b,则a与b的关系正确的是( )
A.b=2a
B.a=2b
C.b>2a
D.b<2a
参考答案:C
本题解析:[思路分析] 本题考查溶质质量分数与溶质物质的量浓度的转化关系。
设溶质质量分数为W、2W的NaOH溶液的密度分别为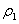 、
、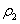 ,并可知
,并可知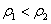 ,
,
则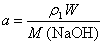 ,
, ,因此
,因此 ,即2a<b。
,即2a<b。
提示:溶质质量分数与溶质物质的量浓度之间的转化,一定要知道溶液密度,并注意溶液浓度不同,密度就不同。
本题难度:简单