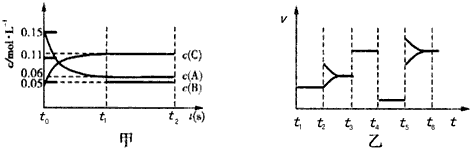
1、选择题 某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化如图甲所示[t0~t1阶段c(B)未画出]。图乙为t2后改变互不相同的某一条件反应速率随时间变化的关 系图,t3~t4阶段使用了催化剂。下列说法错误的是
[? ]
A.若t1=15s,生成物C在t0~t1时间段的平均反应速率为0.004 mol·L-1·s-1
B.t4~t5阶段改变的条件为减小压强,t5~t6阶段改变的条件是升高化学反应的温度
C.B的起始物质的量为0.02 mol
D.该化学反应的表达式为:3A(g) B(g)+2C(g)
B(g)+2C(g)
2、填空题 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中通过以下反应制得
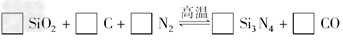
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应中的氧化剂是________,其还原产物是________;
(3)该反应的平衡常数表达式为K=________;
(4)若知上述反应为放热反应,则其反应热ΔH________零(填“大于”“小于”或“等于”);升高温度,其平衡常数值________(填“增大”“减小”或“不变”);
(5)若使压强增大,则上述平衡向________反应方向移动(填“正”或“逆”);
(6)若已知CO生成速率为v(CO)=18?mol/(L·min),则N2消耗速率为v(N2)=________mol/(L·min).
3、填空题 接触法制硫酸的核心反应是2SO2(g)+O2(g)?2SO3(g)△H<0.
(1)该反应的平衡常数K值的表达式:K=______;升高温度,K值将______(填“增大”、“减小”、“不变”)
(2)生产中用过量的空气能使SO2的转化率______(填“增大”、“减小”、“不变”),该反应为何在常压下进行______.
4、填空题 脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源。
(1)硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为______________________________。
(2)用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫,其电解总反应方程式为________________________(忽略氧的氧化还原);该方法的优点是________________________________。
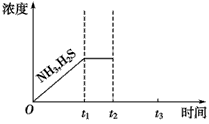
(3)一定温度下,1 mol NH4HS固体在定容真空容器中可部分分解为硫化氢和氨气。
①当反应达平衡时p氨气×p硫化氢=aPa2,则容器中的总压为________Pa;
②下图是上述反应过程中生成物浓度随时间变化的示意图。若t2时增大氨气的浓度且在t3时反应再次达到平衡,请在图上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线。
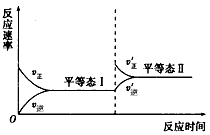
5、选择题 下图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是
[? ]
A.反应达到平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态I后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ
C.该反应达到平衡态I后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ
D.同一种反应物在平衡态I和平衡态Ⅱ时浓度不相等