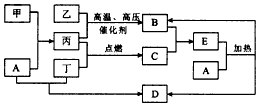
1、推断题 图中所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质。气体B 与气体C相遇产生大量的白烟,D是海水中浓度最高的盐(部分反应物和生成物及溶剂水已略去)。
请回答下列问题:
(1)甲的化学式是______________,C的化学式为__________________________。
(2)写出A溶液和丁反应生成D的离子方程式:_____________________________。
(3)写出A和E反应的化学方程式:____________________________。
2、填空题 有M、A、B、D、E五种短周期元素,其原子序数依次增大,M元素的原子半径是周期表所有元素中最小的。A、B、D、E分别在下表中(周期表的一部分)不同的空格内占有相应的位置,它们的原子序数之和为37。请回答:
(1)元素符号:A??B??D??E?
(2)D、E两种元素分别与M元素形成的最简单化合物中,相对稳定的是?(填化学式),沸点较高的是?(填化学式)。
(3)A、B、D、M可组成多种18电子的分子,其中的两种结构可分别表示为M2B—BM2和
AM3—BM2,请再写出2种具有18电子的有机物的结构简式?、?。
(4)M、B、D以原子个数比4:2:3所形成的离子化合物,其水溶液呈?性。0.1mol/L该化合物的水溶液中各离子的浓度由大到小的排序是?。
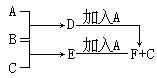
3、实验题 (共14分)A、B、C为3种单质(其中A为固体,B、C为气体),D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E。它们之间的转化关系如下图:
填写下列空白:
(1)(3分)物质A是?,B是?,B的离子结构示意图为?。
(2)(5分)写出化合物E的电子式:?,D的饱和溶液滴入沸水中溶液呈红褐色的原因是(用离子方程式表示):?。D溶液可以用来止血,请简单说明其止血原理是:?。
(3)(4分)工业上把B单质与石灰乳反应可制得漂白粉,漂白粉的有效成份是?,漂白粉常用于自来水的杀菌消毒,原因是(写出反应的化学方程式,并加以适当的文字
说明):?。
(4)(2分)F中加入NaOH溶液,并在空气中放置由白色变为灰绿色最后变成红褐色沉淀的化学方程式是?。
4、简答题 中学化学中常见的物质有如图所示的转化关系(反应条件略去).X、Y、Z、W是单质,其余均为化合物,A、W、Z常温下呈气态,且A是一种大气污染物,B是一种常用的酸.
(1)写出下列物质的化学式:
Y______、A______、C______.
(2)D的电子式为______.
(3)我国生产B的工业中,常采用以下方式处理尾气A:
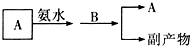
试从综合经济效益的角度分析,这样处理的目的是(答出其中两点即可):
a.______;b.______.
(4)反应①的化学方程式:______.
反应②的化学方程式:______.
反应④的离子方程式:______.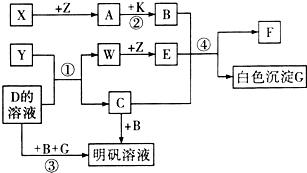
5、推断题 A、B、C、D四种元素原子的核电荷数依次增大(均小于20),其单质及相应的化合物能发生如下反应关系:
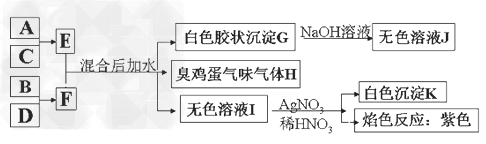
(1)写出F的电子式____________。
(2)气体H有毒,可用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________。
(3)加热E的水溶液后并灼烧,最终得到的固体为____________,?原因为_______________,?____________。(用化学反应方程式来表示)?
(4)室温下,向F的水溶液中加入等体积等浓度的盐酸反应后所得溶液的PH>7,则此溶液中离子浓度由小到大的顺序为:_______________。
(5)将气体H放在空气中充分燃烧可得到气体氧化物BO2,BO2可与氧气继续反应:2BO2+O2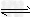 2BO3,在一个固定容积为2L的密闭容器中充入0.20?mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则
2BO3,在一个固定容积为2L的密闭容器中充入0.20?mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则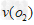 ?=?________?mol·L-1·min-1。若继续通入0.20mol?BO2和0.10mol?O2,再次达到新平衡后,BO3的物质的量介于__________之间。
?=?________?mol·L-1·min-1。若继续通入0.20mol?BO2和0.10mol?O2,再次达到新平衡后,BO3的物质的量介于__________之间。