1、实验题 酸碱中和滴定常用于测定酸碱溶液的浓度。
(1)实践中,在正式测定前,常常用已知浓度的酸(或碱)滴定已知浓度的碱(或酸),测定滴定曲线,然后选择合适的指示剂指示滴定终点,以保证数据的准确性。如:用0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L醋酸(CH3COOH) 溶液,有关数据记录如下表:
V/(NaOH)/mL
| 0.00
| 10.00
| 18.00
| 19.80
| 19.98
| 20.00
| 20.02
| 20.20
| 22.00
| 40.00
|
溶液pH
| 2.87
| 4.74
| 5.70
| 6.74
| 7.74
| 8.72
| 9.70
| 10.70
| 11.70
| 12.50
|
①根据上表数据绘制0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L醋酸(HAc)溶液的滴定曲线。
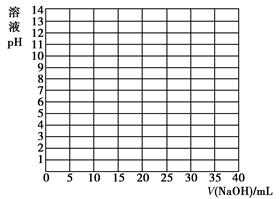
②根据你所绘制的曲线,确定pH的突变范围是________。
③下列指示剂中适合于本实验的是________。(填序号)
A.甲基橙 ? B.石蕊 ? C.酚酞
判断到达滴定终点的实验现象?
(2)滴定过程中,眼睛应重点观察_?_。
参考答案:①略
②7.74~9.70 ③C 无色变为浅红色,且半分钟内颜色不再发生变化?
(2)锥形瓶内溶液颜色的变化
本题解析:略
本题难度:简单
2、实验题 (12分)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
试回答下列问题:
⑴FeCl3蚀刻铜箔反应生成FeCl2和CuCl2的离子方程式为?;
证明蚀刻后的混合物溶液仍存在Fe3+的操作是:?
?。
⑵过程I加入铁屑的主要作用是_______?;从固体中分离出铜需采用的方法是_________?。
⑶过程II中发生主要反应的化学方程式为:_____?,?。
参考答案:⑴2Fe3++Cu=2Fe2++Cu2+?取少量反应后的溶液置于洁净的试管中,向其中滴加KSCN溶液,若产生红色溶液,证明仍存在Fe3+ (合理即得分)
⑵回收铜 加盐酸反应后过滤?
⑶FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2 4Fe(OH)2+O2+2H2O=4Fe(OH)3 (每空2分)
本题解析:(1)对离子方程式的书写,应注意配平。该反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+。检验铁离子的存在应用KSCN溶液。注意语言的描述“取少量反应后的溶液置于洁净的试管中,向其中滴加KSCN溶液,若产生红色溶液,证明仍存在Fe3+”
(2)加入铁屑的主要目的是除去铜离子,回收铜单质。因铜不溶于酸溶液,因此可滴加稀盐酸,使多余的铁反应,从而得到铜单质。
(3)过程Ⅱ加入了石灰水,同时还鼓入了空气,因此发生的反应为FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2、4Fe(OH)2+O2+2H2O=4Fe(OH)3。
点评:本题主要考查了金属的相关性质及其化学方程式的书写。书写化学方程式时,应注意化学方程式的配平。
本题难度:一般
3、简答题 过碳酸钠(2Na2CO3?3H2O2)是一种新型高效固体漂白杀菌剂,它具有无臭、无毒、无污染的特点,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,依托纯碱厂制备过碳酸钠可降低生产成本,其生产流程如下.
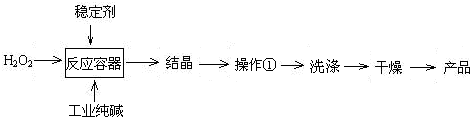
试回答下列问题:
(1)过碳酸钠溶于水后所得溶液一定显______(“酸性”、“碱性”或“中性”).
(2)操作①需要的玻璃仪器有______(填写仪器名称).
(3)工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量.
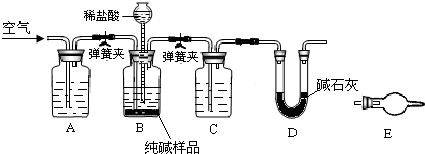
①要检验工业纯碱中杂质的存在,最好选用下列试剂中的______(选填序号).
A.氢氧化钡溶液?B.稀硝酸?C.硫氰化钾溶液?D.硝酸银溶液
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若______,说明装置不漏气.
③装置A的作用是______.装置C中的试剂为______.
④某同学认为在D装置后应再连接E装置(装有适当试剂),你认为是否必要?______(选填“必要”或“不必要”),判断的理由是______.
参考答案:(1)过碳酸钠溶于水后所得溶液,在水溶液中能解离成过氧化氢与碳酸钠,过氧化氢溶液是极弱的弱酸,而碳酸钠在水中由于水解会显示碱性,故答案为:碱性;
(2)操作①是过滤分离固体和溶液,过滤装置需要的玻璃仪器为漏斗、烧杯、玻璃棒,故答案为:普通漏斗、烧杯、玻璃棒;
(3)①纯碱中常含有少量NaCl,用检验氯离子的方法进行检验,需要试剂为硝酸银和稀硝酸,
A.氢氧化钡溶液 不能检验氯离子存在,故A不选;
B.稀硝酸 验证生成的氯化银不溶,故B选;
C.硫氰化钾溶液是检验铁离子的存在,不能检验氯离子,故C不选;
D.硝酸银溶液和氯离子反应生成白色沉淀,加入稀硝酸不溶证明含有氯离子,故D选;
故答案为:BD;
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,利用压强变化和液面变化分析判断,若漏斗中与试剂瓶中的液面差保持不再变化,证明装置气密性完好,
故答案为:漏斗中与试剂瓶中的液面差保持不再变化或漏斗中的液面不再下降;
③装置A是为了吸收空气中二氧化碳,避免影响碳酸钠含量的测定;装置C是浓硫酸干燥生成的二氧化碳气体,在D装置中吸收后称量至恒重,
故答案为:除去空气中CO2,防止影响测量结果;浓硫酸;
④U性管是吸收二氧化碳气体称重来测定碳酸钠含量的方法,若与空气直接接通,会吸收空气中二氧化碳和水蒸气测定结果偏高,影响测定结果的准确性,
故答案为:必要;因为装置E会吸收空气中的二氧化碳和水蒸气,影响测量结果.
本题解析:
本题难度:一般
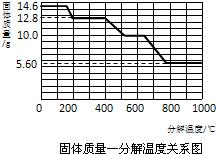
4、简答题 选用如下装置对草酸钙晶体(CaC2O4?H2O)的分解产物进行研究.
下图表示的是草酸钙晶体受热分解时,所得固体产物质量随温度变化的曲线.
(1)按A、B、C顺序连接进行实验,一段时间后,观察到装置B中的无水硫酸铜变蓝,C中溶液变浑浊,证明产物中有______和______.
(2)将B装置中无水硫酸铜换为碱石灰,按A、B、D、C顺序连接进行实验,一段时间后,观察到C装置中溶液变浑浊,B装置的作用是______,D装置中的现象是______,证明草酸钙晶体分解产物中有______.
(3)通过对上图的分析和相关计算,写出图中位于2处的固体物质的化学式______,上图中位于3处固体物质存在的最低温度是______℃.
参考答案:(1)装置B中的无水硫酸铜变蓝,证明A装置产生了水,C中溶液变浑浊,证明A中产生了二氧化碳,
故答案为:水;二氧化碳;
(2)将B装置中无水硫酸铜换为碱石灰,碱石灰具有吸水性,常用作干燥剂,作用是将混合气体干燥,观察到C装置中溶液变浑浊,证明A中产生了二氧化碳,一氧化碳还原氧化铜的产物是红色的金属铜和二氧化碳,
故答案为:将混合气体干燥;固体由黑色变为红色;CO2、CO;
(3)根据图象可知600℃时发生碳酸钙分解反应,800℃时完全分解,则800℃以上时,固体成分为氧化钙,
故答案为:CaCO3和CaO;800.
本题解析:
本题难度:一般
5、实验题 面粉增白剂主要包括过氧化苯甲酰(俗称面粉增白剂)和过氧化钙两种物质。其中过氧化钙(CaO2) 在日常生活和工农业生产中还常用于种子消毒、药物制造、油脂漂白及鱼池增氧等,还可以作为高温氧化剂。已知:过氧化钙与CO2反应有气体生成,而将SO2通入过氧化钙粉末中也有气体生成。有人提出:
CO2、SO2与过氧化钙的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断。
实验一:通过测量气体的体积判断发生的化学反应,实验装置如下

(1)试剂A可以选用____________,试剂B的作用是__________。
(2)装置E用于测定氧气的体积,请在方框中画出装置图。
(3)实验测得装置C中过氧化钙质量增加了m1g,装置D质量增加了m2g,装置E中收集到的气体为VL(已换算成标准状况下),用上述有关测量数据判断,SO2未被氧化、部分被氧化、完全被氧化的V-m1 关系式。未被氧化:__________,部分被氧化:__________, 完全被氧化:__________。若SO2完全被氧化,写出反应的化学方程式:___________________________。
实验二:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
(4)提出假设:
假设1:反应后固体中只有_______________,证明SO2未被氧化;
假设2:反应后固体中只有_______________,证明SO2完全被氧化;
假设3:____________________。
实验探究:
(5)设计实验,证明假设3是正确的,简要回答实验过程、现象和结论:___________________________。 实验评价:
(6)实验过程中SO2的通入量直接影响探究实验结果的科学性,请简要说明原因:__________。
参考答案:(1)浓硫酸;吸收未反应的SO2(2)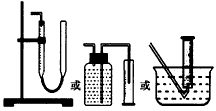 (3)V=7m1/30;0<V<7m1/30;V=0;CaO2+SO2=CaSO4
(3)V=7m1/30;0<V<7m1/30;V=0;CaO2+SO2=CaSO4
(4)假设1:Na2SO3;假设2:Na2SO4;假设3:固体为Na2SO3和Na2SO4的混合物,证明二氧化硫部分被氧化
(5)取反应后的固体放入试管中,加少量水溶解,加入BaCl2溶液有白色沉淀产生,再加入稀盐酸,沉淀部分溶解,证明原固体中既有亚硫酸钠也有硫酸钠,即Na2O2将SO2部分氧化
(6)若Na2O2有剩余,固体加水溶解时,过氧化钠能将SO32-氧化成SO42-,检验出SO42-时不能说明其是过氧化钠与SO2反应生成的
本题解析:
本题难度:困难