1、实验题 已知HA为一元弱酸,某兴趣小组设计实验探究HA与乙酸(CH3COOH)、甲酸(HCOOH)的酸性强弱,查阅资料如下

(1)已知25℃时,乙酸和甲酸的电离常数分别是1.75×10-5和1.7×10-4,通过分析可知,乙酸的酸性______(填“强 于”、“弱于”或“等于”)甲酸。
(2)请完成下列探究实验: 供选实验试剂与仪器:0.1 mol·L-1的CH3COONa、0.1mol·L-1的NaA、pH=2的
HCOOH、pH=2的HA、蒸馏水、精密pH试纸、烧杯、量筒、玻璃棒。
I.提出合理假设
假设1:HA的酸性比甲酸、乙酸强。假设2:HA的酸性比甲酸、乙酸弱。假设3:_______________。
Ⅱ.甲组同学设计如下实验方案证明假设1和假设2,写出预期现象。

2、选择题 下列各实验装置图的叙述中,正确的是( )
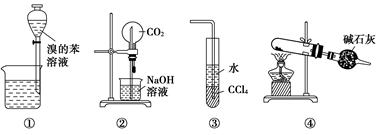
A.装置①为放出萃取溴水后的苯层
B.装置②为喷泉实验
C.装置③可用来吸收HCl气体
D.以NH4Cl为原料,装置④可用于制备少量NH3
3、实验题 现用如下实验装置测定铜和氧化铜混合物中铜元素的含量。
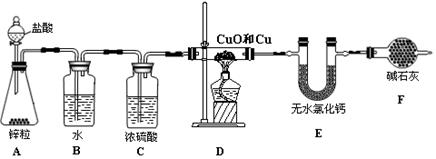
试回答下列问题:
(1)A中盛装盐酸的仪器名称为?。
(2)A中可观察到的现象为?。
(3)B装置的作用是?。
(4)在给D装置加热前,应该进行的一步操作是?,其目的是:
?。
(5)已知D装置中铜和氧化铜混合物的质量为10 g,经称量,反应前后E装置的质量分别为100.2 g和102.0 g,原混合物中铜元素的质量分数为?(假设各装置中的反应或吸收都是完全的)。
(6)如不加F装置,会使实验结果??(填“偏低”或“偏高”)。
4、选择题 下列物质的提纯方法不正确的是( )
A.铝粉中混有镁粉:加足量的氢氧化钠溶液,然后过滤即可
B.氯气中混有氯化氢:用饱和食盐水洗气
C.自来水中混有少量Fe3+:采用蒸馏方法
D.固体MnO2中混有KCl:加水,然后过滤
5、实验题 某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
[实验]制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是_______________。
a.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水。至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2 mL乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
[提出假设]
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag。
[设计实验方案,验证假设]
(2)甲同学从上述实验的生成物中检验出Fe3+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式:
______________________。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生)。

[思考与交流]
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立。则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO3-都氧化了Ag。你是否同意丙同学的结论,并简述理由:__________________________。