1、填空题 (16分)某兴趣小组为验证日常生活用的火柴头上只含有KClO3、MnO2、S,设计了以下实验流程图,请回答以下问题:

(1) 写出步骤①中可能发生一个反应的化学方程式?。
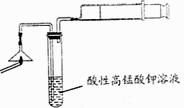
(2)为验证气体A,按下图所示进行实验:若能观察到?的现象,即可证明火柴头上含有S元素。
(3) 步骤②的实验操作装置如下图所示
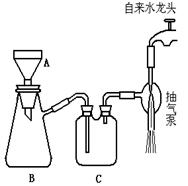
a.该操作的名称是?。
b.写出图中A仪器的名称: __?___;
c.该装置图有几处错误.
请指出
B仪器处关键性的错误:__________ C仪器处的错误改进后应是:?。
(4)要证明火柴头中含有Cl元素,
在步骤②以后的实验步骤是?。
(5)有学生提出检验火柴头上中含有Cl元素,另一套实验方案:

请写出有关的离子反应方程式为?,有人提出上述方法中出现白色沉淀并不能充分说明火柴头上KClO3的存在,其理由是?。
参考答案:(共16分)
(1)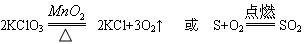 (2分)
(2分)
(2)KMnO4溶液(紫红色)褪色(2分)
(3)a.减压过滤(或抽滤)(2分)
b.A布氏漏斗;(2分)
c.布氏漏斗颈口没有朝向吸滤瓶的支管口,或布氏漏斗的颈口斜面没有与吸滤瓶的支管口相对。(1分);短进长出.(1分)
(4)取少量滤液C,加入HNO3和AgNO3溶液,若观察到白色沉淀产生,即可证明火柴头中含有氯元素。(2分)
(5)ClO3?+3NO2-+Ag+=AgCl↓+3NO3?(2分)
AgNO2与AgCl均为不溶于水的白色沉淀。或者应加HNO3溶液(2分)
本题解析:略
本题难度:简单
2、简答题 某同学设计了图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请回答:
(1)若A为浓氨水,B为烧碱,C为AlCl3溶液,打开分液漏斗旋塞,烧瓶中即有氨气生成,
原因是______(结合离子方程式回答).一段时间后,观察到试管中的现象是______,
发生反应的离子方程是______.
(2)利用该装置设计实验证明醋酸、碳酸、苯酚的酸性强弱,若B为碳酸钠,A与B发生反应的离子方程式是______,能得到的相应结论是______;试管中出现浑浊,依据此现象能否得出相应的结论,请简述理由:______.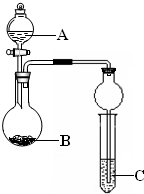
参考答案:(1)NaOH(固体)溶于放热,温度升高,氨气的溶解度变小,氨气溢出,NaOH溶于水,增大OH-的浓度,氨气溶于水是可逆的,NH3+H2O?NH3?H2O?NH4++OH-,氨气溶解度变小,氨气溢出,促使化学平衡逆向移动;氨气从图中左边装置逸到右边装置中,C为AlCl3溶液电离出铝离子和氯离子,NH3+H2O?NH3?H2O?NH4++OH-,铝离子和氢氧根离子反应,生成氢氧化铝白色沉淀,
故答案为:在氨水中有下列平衡:NH3+H2O?NH3?H2O?NH4++OH-,NaOH固体溶于水放热,使得氨气的溶解度减小,同时增大了溶液中的c(OH-),促使化学平衡逆向移动;有白色沉淀产生;Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
(2)醋酸和碳酸都是弱酸,但相同浓度的醋酸和碳酸,醋酸的电离程度比碳酸强,所以醋酸的酸性比碳酸强,根据强酸制弱酸的特点,所以醋酸能和碳酸钠反应生成碳酸,若B为碳酸钠,A为醋酸,醋酸能和碳酸钠反应生成碳酸,但碳酸不稳定能分解生成水和二氧化碳,方程式为CO32-+2CH3COOH→2CH3COO-+H2O+CO2↑,试管中出现浑浊,看到澄清的苯酚钠溶液变浑浊,原因是苯酚钠和水、二氧化碳反应生成苯酚和碳酸氢钠,醋酸具有挥发性,也可能是苯酚钠和乙酸反应生成苯酚,所以不能判断,
故答案为:CO32-+2CH3COOH→2CH3COO-+H2O+CO2↑;醋酸酸性强于碳酸;不能,因为醋酸具有挥发性,挥发出的醋酸也可以和苯酚钠溶液发生反应,生成苯酚;
本题解析:
本题难度:一般
3、实验题 新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)氯气能使湿润的红色布条褪色。使其褪色的微粒的化学式是______?
(2)将氯水在光照上一段时间,溶液颜色逐渐变浅,其有关反应的化学方程式为:
?、?
(3)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度 越大。
越大。
H2CO3? ?
? + H+? Ka1(H2CO3)=4.45×10—7
+ H+? Ka1(H2CO3)=4.45×10—7
 ?
? ?
? +H+? Ka2(HCO3-)=5.61×10-11
+H+? Ka2(HCO3-)=5.61×10-11
HclO ? H++
H++ ? Ka(HClO)=2.95×10-8
? Ka(HClO)=2.95×10-8
请依据以上电离平衡常数,请写出将少量的氯气通入到过量的碳酸钠溶液中所发生反应的离子方程式: ?
(4)饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。
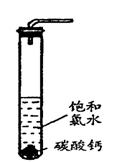
实验一、定性研究:
①?在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,
有少量气泡产生,溶液浅黄绿色褪去;
② 过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③ 为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。?
经检测,上述实验中产生的无色气体均为CO2。
请回答:
① 反应后所得的溶液漂白性增强的原因是______?___________?____?
②依据上述实验可推知:②的滤液中的溶质除CaCl2、HClO外,还含有_______?。
实验二、定量研究:?
在圆底烧瓶底部,有一用塑料网包住的过量块状?碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液 面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。
面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。
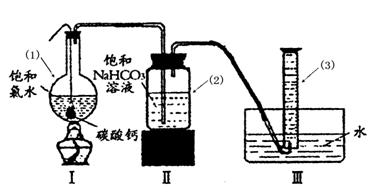
请回答:
③写出仪器(1)与仪器(3)的名称
(1)?(3)?
④为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是?。
⑤如何准确读出量筒中气体的体积
a________?_??
b 上下移动量筒至量筒内液面与水槽液面相平
c ?
参考答案:(1)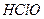 ?(1分)?
?(1分)?
(2) +
+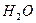

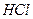 +
+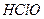 (1分)?
(1分)?
2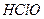
 ?2
?2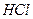 +
+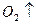 ?(1分)
?(1分)
(3) +2
+2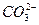 +
+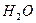
 2
2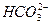 +
+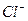 +
+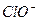 ?(2分)
?(2分)
(4)①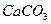 消耗了氯水中的
消耗了氯水中的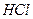 ,使
,使 +
+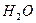

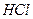 +
+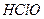 平衡向右移动
平衡向右移动 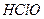 浓度增大(2分)
浓度增大(2分)
②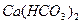 ?(写名称也对)2分
?(写名称也对)2分
③(1)圆底烧瓶?(1分)?(3)量筒(1分)
④在导管末端再连接长导管,使导管的出口接近量筒底部(2分)
⑤a烧瓶冷却至室温 (1分)? c平视刻度线读数(1分)
本题解析:略
本题难度:一般
4、选择题 限用下列一种试剂鉴别氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液,这种试剂是( )
A.KSCN
B.HCl
C.BaCl2
D.NaOH
参考答案:取五种溶液分别滴加NaOH溶液时,产生白色沉淀的是氯化镁;先产生沉淀,后沉淀溶解的是氯化铝;产生红褐色沉淀的是氯化铁;产生白色沉淀,后又变灰绿色,最后变成红褐色的是氯化亚铁;无现象的是氯化钠,而加入KSCN只能检验氯化铁,加入盐酸和氯化钡不能检验任何物质,
故选D.
本题解析:
本题难度:一般
5、选择题 下列有关实验装置及选项中的说法均正确的是
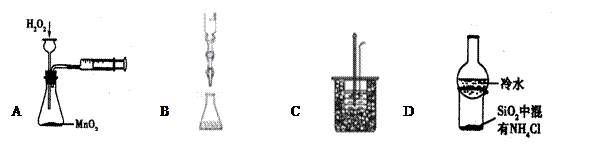
A.实验目的:定量测定化学反应速率
B.实验原理:利用氧化还原反应原理,用酸性高锰酸钾溶液滴定亚硫酸钠溶液,测定亚硫酸钠溶液的浓度
C.实验过程中某步骤:将0.1mol/L50mLNaOH溶液逐滴加入到0.1mol/L55mL盐酸溶液中
D.加热烧杯,分离SiO2和NH4Cl的现象:烧杯底部有白色固体出现
参考答案:D
本题解析:略
本题难度:一般