1、选择题 KBr溶液中混有K2S、KI,为了除去杂质并将它们逐一分离,采用如下操作:①加溴水;②加碘水;③用苯萃取;④过滤;⑤分液.
正确的操作顺序是( )
A.①②④③⑤
B.②④①③⑤
C.①③⑤②④
D.④⑤③②①
参考答案:因还原性S2->I-,应先加②碘水置换出S,选④过滤除去S后,向滤液中再加①溴水置换出碘,然后选③用苯萃取,最后选⑤分液,则下层为KBr溶液,则正确的顺序为②④①③⑤,故选B.
本题解析:
本题难度:简单
2、选择题 为探究一溴环己烷( )与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:甲:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成则可证明发生了消去反应。乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应。其中正确的是
)与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:甲:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成则可证明发生了消去反应。乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应。其中正确的是
[? ]
A.甲
B.乙
C.丙
D.上述实验方案都不正确
参考答案:D
本题解析:
本题难度:简单
3、实验题 面粉增白剂主要包括过氧化苯甲酰(俗称面粉增白剂)和过氧化钙两种物质。其中过氧化钙(CaO2) 在日常生活和工农业生产中还常用于种子消毒、药物制造、油脂漂白及鱼池增氧等,还可以作为高温氧化剂。已知:过氧化钙与CO2反应有气体生成,而将SO2通入过氧化钙粉末中也有气体生成。有人提出:
CO2、SO2与过氧化钙的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断。
实验一:通过测量气体的体积判断发生的化学反应,实验装置如下

(1)试剂A可以选用____________,试剂B的作用是__________。
(2)装置E用于测定氧气的体积,请在方框中画出装置图。
(3)实验测得装置C中过氧化钙质量增加了m1g,装置D质量增加了m2g,装置E中收集到的气体为VL(已换算成标准状况下),用上述有关测量数据判断,SO2未被氧化、部分被氧化、完全被氧化的V-m1 关系式。未被氧化:__________,部分被氧化:__________, 完全被氧化:__________。若SO2完全被氧化,写出反应的化学方程式:___________________________。
实验二:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
(4)提出假设:
假设1:反应后固体中只有_______________,证明SO2未被氧化;
假设2:反应后固体中只有_______________,证明SO2完全被氧化;
假设3:____________________。
实验探究:
(5)设计实验,证明假设3是正确的,简要回答实验过程、现象和结论:___________________________。 实验评价:
(6)实验过程中SO2的通入量直接影响探究实验结果的科学性,请简要说明原因:__________。
参考答案:(1)浓硫酸;吸收未反应的SO2(2)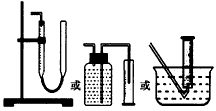 (3)V=7m1/30;0<V<7m1/30;V=0;CaO2+SO2=CaSO4
(3)V=7m1/30;0<V<7m1/30;V=0;CaO2+SO2=CaSO4
(4)假设1:Na2SO3;假设2:Na2SO4;假设3:固体为Na2SO3和Na2SO4的混合物,证明二氧化硫部分被氧化
(5)取反应后的固体放入试管中,加少量水溶解,加入BaCl2溶液有白色沉淀产生,再加入稀盐酸,沉淀部分溶解,证明原固体中既有亚硫酸钠也有硫酸钠,即Na2O2将SO2部分氧化
(6)若Na2O2有剩余,固体加水溶解时,过氧化钠能将SO32-氧化成SO42-,检验出SO42-时不能说明其是过氧化钠与SO2反应生成的
本题解析:
本题难度:困难
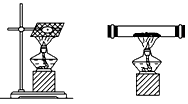
4、实验题 钠在空气中燃烧(如下图所示)生成产物的固体物质中除有淡黄色粉末外,还有黑色固体物质--碳。
(1)请假设黑色固体物质产生的可能原因是:假设①_________;假设②_________;假设③_________。
(2)为确认假设的正误,某同学进行如下推断:由于金属钠与氧的结合能力比碳强,因此黑色碳可能是二氧化碳与金属钠发生置换反应而生成。该同学设计实验如下:用打孔器钻取一段金属钠,取中间一小块钠放在充满二氧化碳气体的试管(如上图所示)中加热,观察到钠燃烧发出黄色火焰,并有淡黄色固体和黑色固体生成,生成的淡黄色固体立即变成白色。请回答下列问题:
①用打孔器取金属钠的原因是__________________;
②产生以上现象的化学反应为:__________________。
参考答案:(1)①金属钠上有没擦干净的煤油,不完全燃烧后生成的碳;②酒精不完全燃烧生成的碳;③酒精燃烧产生的二氧化碳(或空气中的二氧化碳)与金属钠反应生成的碳
(2)①取得较纯的Na;②2Na+CO2 C+Na2O2、2Na2O2+2CO2==2Na2CO3+O2或Na2O2+2Na==2Na2O
C+Na2O2、2Na2O2+2CO2==2Na2CO3+O2或Na2O2+2Na==2Na2O
本题解析:
本题难度:一般
5、简答题 现有失去标签的氯化钙、硝酸银、盐酸、碳酸钠四种无色溶液,为了确定四种溶液各是什么,将它们随意编上A、B、C、D后,产生的现象如下表所示.根据实验现象回答(1)A、B、C、D溶液中溶质的化学式:
A______;B______;C______;D______;
| 实验顺序 | 实验内容 | 实验现象
①
A+B
没有现象发生
②
B+D
有气体放出
③
B+C
有沉淀生成
④
A+D
有沉淀生成
|
(2)D和足量B的反应方程式为______.A和D的反应方程式为______.
参考答案:(1)B和D有气体生成,只有碳酸钠和盐酸反应能生成气体,所以B和D是盐酸和碳酸钠,A和C是氯化钙和硝酸银;A和B没有现象发生,只有氯化钙和盐酸混合没有现象,所以所以B是盐酸,A是氯化钙,故D是碳酸钠,C是硝酸银,
故答案为:CaCl2;HCl;AgNO3;Na2CO3;
(2)碳酸钠和足量盐酸反应生成氯化钠和水、二氧化碳,反应的化学方程式为2HCl+Na2CO3=2NaCl+H2O+CO2 ↑,氯化钙和碳酸钠反应生成碳酸钙和氯化钠,反应的化学方程式为Na2CO3+CaCl2=CaCO3 ↓+2NaCl,
故答案为:2HCl+Na2CO3=2NaCl+H2O+CO2 ↑;Na2CO3+CaCl2=CaCO3 ↓+2NaCl.
本题解析:
本题难度:一般