1、填空题 (10分)某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:
(1)取样品a g。
(2)将样品溶于足量稀盐酸中,过滤,滤液中主要含有的金属阳离子为________;滤渣中含有的物质为____________;
(3)往滤液中加入过量NaOH溶液,过滤,写出该步操作中与铝的化合物有关的离子方程式_____________________________。
(4)在第(3)步的滤液中通入足量CO2,过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至重量不再减少为止,冷却后称量,质量为b g。写出足量CO2通入滤液中所涉及的化学方程式________________。
(5)计算:该样品中铝的质量分数的表达式为___________________________。
参考答案:(10分) 1.(2)Mg2+、Al3+ (2分)? Cu、Si (2分)
(3) Al3++3OH-===Al(OH)3↓,Al(OH)3+OH-===AlO2-+2H2O
或Al3++4OH-=AlO2-+2H2O?(2分)
(4)NaAlO2+CO2+2H2O===NaHCO3+Al(OH)3↓?(2分)(5) 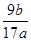 ×100%?(2分)
×100%?(2分)
本题解析:(2)单质铜和硅与盐酸不反应,所以将样品溶于足量稀盐酸中,过滤,滤液中主要含有的金属阳离子为Mg2+、Al3+,滤渣中含有的物质为Cu、Si。
(3)由于氢氧化铝是两性氢氧化物,所以往滤液中加入过量NaOH溶液,生成氢氧化镁白色沉淀,而铝离子先生成氢氧化铝白色沉淀,然后又溶解,反应的离子方程式分别是Al3++3OH-===Al(OH)3↓,Al(OH)3+OH-===AlO2-+2H2O或Al3++4OH-=AlO2-+2H2O。
(4)偏铝酸钠能和CO2反应生成氢氧化铝白色沉淀,由于CO2过量,所以反应的化学方程式是NaAlO2+CO2+2H2O===NaHCO3+Al(OH)3↓。
(5)最终生成的是氧化铝,质量是bg,则根据原子守恒可知,该样品中铝的质量分数的表达式为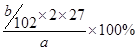 =
=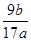 ×100%。
×100%。
点评:该题是中等难度的试题,试题贴近高考,难易适中,注重能力的培养和解题方法的训练,注重解题的灵活性。有利于培养学生的逻辑推理能力和发散思维能力,提高学生分析问题、解决问题的能力。有助于提高学生的应试能力和灵活应变能力。
本题难度:一般
2、选择题 下列能达到实验目的的是
 ?
?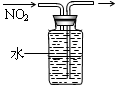 ?
? ?
?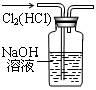
A.防倒吸
B.排水法收集NO2
C.实验室制氨气
D.除去杂质气体HCl
参考答案:A
本题解析:A HCl容易溶解在水中,而不易溶解在四氯化碳中,这样既可以充分吸收,也可以防止倒吸现象的发生。正确。B二氧化氮和水发生反应生成硝酸和一氧化氮,故不可以用排水法收集气体。错误。C氯化铵不稳定受热易分解产生氨气和氯化氢,二者遇冷又重新生成氯化铵,所以不能用加热氯化铵的方法制取氨气。错误。D氯气和氯化氢都与氢氧化钠发生反应,所以不能用氢氧化钠溶液来除去氯气中的氯化氢。错误。
本题难度:一般
3、选择题 下列气体中,不能用排空气收集的是
A.NO
B.NO2
C.CO2
D.H2
参考答案:A
本题解析:NO极易被氧气氧化生成NO2,所以不能用排气法收集,而是用排水法收集。其余都可以用排气法收集,所以答案是A。
本题难度:一般
4、实验题 (8分)碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:?KIO3+5KI+3H2SO4 =3I2+3H2O+3K2SO4?
=3I2+3H2O+3K2SO4?
(1)先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,最后加入一定量的CCl4,震荡,这时候,观察到的现象是___________________________;
(2)某学生在一次分液操作中发现溶液都是无色液体,无法知道分液漏斗中的液体哪一层是有机层,哪一层是水层,请你用简单的方法帮他鉴别出来,写出有关步骤及判断依据:?。
(3)上面实验中用到一定物质的量浓度的稀硫酸,现用浓硫酸配制该稀硫酸,下面操作造成所配稀硫酸溶液浓度偏高的是_____________
A.溶解的时候溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
(4)用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是( )
A、干燥的 B、瓶塞不漏水 C、用欲配制的溶液润洗过 D、以上三项都要求
参考答案:

本题解析:略
本题难度:简单
5、实验题 B. [实验化学]
次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)在印染、医药以及原子能工业中应用广泛。以Na2SO3、SO2、HCHO 和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
步骤1:在烧瓶中(装置如图 所示) 加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液。步骤2:将装置A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80 ~ 90益下,反应约3h,冷却至室温,抽滤。步骤3:将滤液真空蒸发浓缩,冷却结晶。
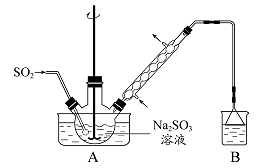
(1)装置B 的烧杯中应加入的溶液是?。
(2)①步骤2 中,反应生成的Zn(OH)2会覆盖在锌粉表面阻止反应进行,防止该现象发生的措施是??
?。②冷凝管中回流的主要物质除H2O 外还有?(填化学式)。
(3)①抽滤装置所包含的仪器除减压系统外还有?、?(填仪器名称)。②滤渣的主要成分有?、?(填化学式)。
(4)次硫酸氢钠甲醛具有强还原性,且在120益以上发生分解。步骤3 中不在敞口容器中蒸发浓缩的原因是?。
参考答案:

本题解析:(1)装置B用来吸收剩余的SO2尾气,应该用NaOH溶液吸收。(2)①防止Zn(OH)2附着在锌粉的表面可用快速搅拌的方法。②反应物中的甲醛沸点较低,具有挥发性,会在冷凝管中冷却。(3)抽滤装置还包含布氏漏斗和吸滤瓶。滤渣中含有生成的Zn(OH)2以及部分未反应的锌。(4)由题意知,次硫酸氢钠甲醛具有强还原性,真空蒸发的目的是防止其被空气中的氧气氧化。
【考点定位】化学实验模块
本题难度:一般