1、选择题 图中装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于( )

A.锌和盐酸生成氢气
B.亚硫酸钠和浓硫酸生成二氧化硫
C.碳酸钙和盐酸生成二氧化碳
D.浓氨水和烧碱制取氨气
参考答案:A
本题解析:A项可用于此装置;B项,二氧化硫能溶于水,且密度比空气大,所以B项错误;C项,二氧化碳能溶于水且密度比空气大,C项错误;D项,氨气极易溶于水,D项错误。
本题难度:一般
2、选择题 以下是几种常见的实验室制取气体的装置,其中可用于制取乙炔的是(? )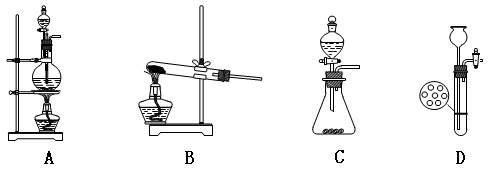
参考答案:C
本题解析:依据乙炔实验室制备的原理,可知制取装置为:固体+液体→气体,且固体电石易与水反应变成粉末状物质,不能用装置D,只能用装置C。
本题难度:简单
3、选择题 用98%的浓H2SO4(密度为1.84 g/mL)配制1 mol?L-1的稀H2SO4 100mL,配制过程中可能用到下列仪器: ①100mL量筒;②10mL量筒;③50mL烧杯;④托盘天平;⑤100mL容量瓶;⑥胶头滴管;⑦玻璃棒。按使用出现的先后顺序排列正确的是?(?)
A.②⑥③⑦⑤
B.④③⑤⑦⑥
C.①③⑦⑤⑥
D.②⑤⑦⑥
参考答案:A
本题解析:由于稀释过程中,溶质是不变的,所以需要浓硫酸的体积是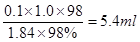 ,所以需要10ml量筒和胶头滴管。稀释应该在烧杯中进行,同时还需要玻璃棒搅拌;转移和定容时还分别需要100ml容量瓶和胶头滴管,答案选A。
,所以需要10ml量筒和胶头滴管。稀释应该在烧杯中进行,同时还需要玻璃棒搅拌;转移和定容时还分别需要100ml容量瓶和胶头滴管,答案选A。
本题难度:简单
4、填空题 (14分)硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
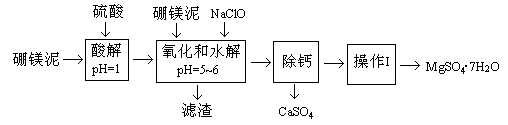
根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有?。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有?。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式?。在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为?。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法?。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃)
| 40
| 50
| 60
| 70
|
MgSO4
| 30.9
| 33.4
| 35.6
| 36.9
|
CaSO4
| 0.210
| 0.207
| 0.201
| 0.193
|
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤?、?。
(6)如果提供的硼镁泥共100 g,得到的MgSO4·7H2O 196.8 g,则MgSO4·7H2O的产率为?。
参考答案:(1)烧杯、100mL的容量瓶、胶头滴管?(2分)?(2)SiO2(2分)
(3)Mn2+ + ClO- + H2O → MnO2↓ + 2H+ + Cl-?(2分)
2Fe2+ + ClO- + 2H+ → 2Fe3+ + Cl- + H2O?(2分)
(4)取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+。?(2分)
(5)蒸发浓缩,趁热过滤?(2分)?(6)80%?(2分)
本题解析:1、配制溶液时还需要的玻璃仪器有烧杯、100mL的容量瓶、胶头滴管,
2、由于pH=5-6溶液呈酸性,所以滤渣中还有二氧化硅。
3、Mn2+与ClO-反应生成了MnO2沉淀H+和 Cl-。
Fe2+在酸性条件下被ClO-氧化为Fe3+、Cl-和 H2O。
4、取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+。
5、观察图表可以知道两种物质随着温度的升高溶解度一种增大一种减小,可以利用溶解度的不同来分离。
6、根据元素守恒可以计算出硼镁泥中镁的质量,在计算出196.8 g MgSO4·7H2O中镁的质量就可以计算出其产率了。
点评:本题属于简单题,难度不大,但是知识点较多,做题时先分析图表,了解每一步的设计作用,再进行做题。
本题难度:一般
5、实验题 (8分)
用实 验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸。其具体实验步骤如下:
验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸。其具体实验步骤如下:
①取一支碱式滴定管(如图有两只滴定管,你选择哪一只?)?(填写对应字母),用少量标准NaOH溶液润洗2~3次水洗后的碱式滴定管,再加入标准的0.100mol/L的NaOH溶液并记录液面刻度读数;

②用酸式滴定管精确地放出25.00mL待测盐酸,置于用蒸馏水洗净的锥形瓶中。再加入酚酞试液2滴;
③滴定时,边滴边振荡,同时眼睛注视锥 形瓶内溶液颜色的变化,当锥形瓶内溶液由
形瓶内溶液颜色的变化,当锥形瓶内溶液由
?(填写颜色变化)且半分钟内不褪色时,即达到滴定终点;
④记录液面刻度读数。根据滴定管的两次读数得出消耗标准盐酸的体积,再重复测定两次,实验结果记录见下表:
实验次数
| 起始滴定管读数
| 终点滴定管读数
|
1
| 0.00mL
| 24.02mL
|
2
| 0.50mL
| 24.46mL
|
3
| 1.00mL
| 25.02mL
|
测得未知稀盐酸的物质的量浓度为?(保留小数点后3位)。
⑤如果滴定结束时俯视碱式滴定管刻度读数(其它操作均正确),则对滴定结果稀盐酸浓度的影响是?(填“偏高”、“偏低”或“无影响”)。
参考答案:① b?③无色→浅红色?④ 0.096mol/L?⑤偏低
本题解析:略
本题难度:一般