1、实验题 (16分)(1)小明在做“研究温度对反应速率的影响”实验时,他取了两只试管,均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于凉水中,记录溶液褪色所需的时间。
①需要用 来酸化KMnO4溶液,褪色所需时间tA tB(填“>”、“=”或“<”)。
②写出该反应的离子方程式 。
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,操作为:
①配制250 mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液。
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000 mol·L-1 KMnO4溶液装入 (填“酸式”或“碱式”)滴定管,进行滴定操作。在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。将锥形瓶摇动一时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了。请解释原因: 。当____ ,证明达到滴定终点。
③计算:再重复上述操作2次,记录实验数据如下。
序号
| 滴定前读数(mL)
| 滴定后读数(m L)
|
1
| 0.00
| 20.10
|
2
| 1.00
| 20.90
|
3
| 0.00
| 22.10
|
则消耗KMnO4溶液的平均体积为 mL,已知H2C2O4的相对分子质量为90,则此样品的纯度为 。
④误差分析:下列操作会导致测定结果偏高的是__________。
A 未用标准浓度的酸性KMnO4溶液润洗滴定管
B 滴定前锥形瓶有少量水
C 滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视
参考答案:(1)①硫酸(1分), < (1分)
②5H2C2O4 + 2MnO4- + 6H+=10CO2↑ + 2Mn2+ + 8H2O (3分,不配平或配平错扣1分)
(2)②酸式 (2分);反应中生成的Mn2+具有催化作用,所以随后褪色会加快 (2分);滴入最后一滴KMnO4溶液,锥形瓶内的颜色恰好变成浅紫红色,且半分钟不变化。(2分)
③20.00mL(2分); 90.00% (2分)④ACD (2分) (漏写一个得1分)
本题解析:(1)①高锰酸钾具有强氧化性,要酸化高锰酸钾溶液需要选用无还原性的酸,一般选稀硫酸,温度越高反应速率越快,则褪色时间越短,所以褪色所需时间tA<tB;
②酸性条件下,高锰酸根离子能氧化草酸生成二氧化碳,自身被还原生成锰离子,同时生成水,发生的离子反应方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O;
(2)②酸性溶液只能盛放在酸式滴定管中,所以酸性高锰酸钾溶液应该盛放在酸式滴定管中,高锰酸根离子被还原生成的锰离子有催化作用而导致反应速率加快,当滴入最后一滴高锰酸钾溶液,锥形瓶内的颜色恰好变成紫红色且半分钟不变化,证明达到终点;
③第三次消耗体积与第一次和第二次相差较大,所以要舍去,则消耗KMnO4溶液的平均体积=(20.10?0.00+20.90?1.00)÷2mL=20.00mL,设样品的纯度为x,
5H2C2O4+6H++2MnO4-=10CO2↑+2Mn2++8H2O
450g 2mol
5.0x×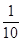 g (0.1×0.020)mol
g (0.1×0.020)mol
x= 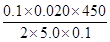 ×100%=90.00%;
×100%=90.00%;
A.酸式滴定管水洗后未用待测液润洗,会导致酸性高锰酸钾浓度偏小,需要高锰酸钾体积偏大,测定值偏大,故正确;B.锥形瓶内有水,对实验无影响,故错误;C.定管尖嘴部分有气泡,滴定后消失,会导致测定高锰酸钾体积偏大,测定值偏大,故正确;D.不小心将少量酸性KMnO4溶液滴在锥形瓶外,会导致测定高锰酸钾体积偏大,测定值偏大,故正确;E.观察读数时,滴定前仰视,滴定后俯视,导致测定高锰酸钾体积偏小,测定值偏小,故错误;故选ACD。
考点:考点探究物质的组成及其含量的测定的实验方案设计与评价
本题难度:困难
2、选择题 下列说法错误的是
A.在C(s) +H2O(g) 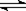 CO(g) + H2(g)反应体系中,增加碳的量不能迅速提高正反应速率
CO(g) + H2(g)反应体系中,增加碳的量不能迅速提高正反应速率
B.钾的金属性比钠强,所以钾与水的反应比钠的反应剧烈
C.在压强相同条件下,结构相似的CH4、SiH4、GeH4的沸点依次升高,所以结构相似的HF、HCl、HBr、HI的沸点也依次升高
D.面粉厂严禁烟火的原因是面粉粉尘表面积大,与空气接触遇明火极易发生爆炸
参考答案:C
本题解析:略
本题难度:简单
3、选择题 将等质量的a、b两份锌粉装入试管中,分别加入过量的稀硫酸,同时向装a的试管中加入少量CuSO4溶液。右图表示产生氢气的体积V与时间t的关系,其中正确的是(?)
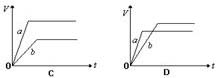
参考答案:D
本题解析:向装a的试管中加入少量CuSO4溶液,则锌和硫酸铜发生置换反应,生成铜,则可以构成原电池,锌是负极,加快反应速率。但由于消耗了部分锌,则生成的氢气减少,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题设计新颖,综合性强,侧重对学生解题能力和技巧的培养和训练,有利于培养学生的逻辑推理能力和发散思维能力,提高学生的应试能力和学习效率。该题的关键是明确原电池原理,并能结合题意灵活运用即可。
本题难度:简单
4、填空题 向2.0L恒容密闭容器中充人1.0mol PCl5,在温度为T时发生如下反应
PCl5(g)  PCl3(g)+C12(g)?
PCl3(g)+C12(g)?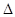 H=124kJ·mol-1。反应过程中测定的部分数据见下表:
H=124kJ·mol-1。反应过程中测定的部分数据见下表:
时间t/s
| 0
| 50
| 150
| 250
| 350
|
n(PCL3)/mol
| 0
| 0.16
| 0.19
| 0.2
| 0.2
|
?
回答下列问题
(1)反应在前50 s的平均速率v(PCI5)=________。
(2)温度为T时,该反应的化学平衡常数=________。
(3)要提高上述反应的转化率,可采取的措施有________。
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a=________。
(5)在热水中,五氯化磷完全水解,生成磷酸(H3 PO4),该反应的化学方程式是________。
若将0.01 mol PCI5投入l L热水中,再逐滴加入AgNO3溶液,先产生的沉淀是________ [已知Ksp(Ag3 PO4)="1.4" x 1 0-16,Ksp(AgCl)="1.8" x 10-10]。
(6)一定条件下,白磷溶于硝酸溶液产生一种氮氧化合物气体,该气体与白磷的物质的量之比为20:3,反应的化学方程式为____________________________。
参考答案:
(1)0.0016 mol/( L·s) (2)0.025
(3)升高温度(或降低压强或移走PCl3、Cl2等合理答案)
(4)0.1?(5)PCl5+4H2O = H3PO4+5HCl?AgCl
(6)3P4 + 20HNO3 + 8H2O = 12H3PO4 + 20NO↑
本题解析:(1)反应在前50 s的平均速率v(PCI3)=Δc/Δt=0.16mol÷2.0L÷50s=0.0016mol/(L·s).由于v(PCI5)= v(PCI3)= 0.0016 mol/( L·s).由表中数据可以看出,在温度为T,当反应达到平衡时,n(PCI3)=" 0.2mol" ,n(C12)=0.2mol.,n(PCI5)=0.8mol.所以c(PCI5)=0.4mol/L;c(PCI3)=0.1mol/L;c(C12)=0.1mol/L,所以化学平衡常数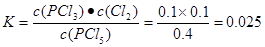 .(3)由于该反应的正反应为气体体积增大的吸热反应,所以要提高上述反应的转化率,可采取的措施有减小压强,或升高温度或从平衡混合物中分离出PCl3、Cl2等措施。(4)由于起始时向容器中充入0.5mol PCl5和a mol Cl2,而且平衡时PCl5的转化率仍为20%,则达到平衡时n(PCl5)=0.4mol;n(PCl3)=0.1mol;n(Cl2)= (0.1+a)molc(PCl5)=" 0.2mol/L," c(PCl3) =0.05mol/Lc(Cl2)="(0.1+a)/2L"
.(3)由于该反应的正反应为气体体积增大的吸热反应,所以要提高上述反应的转化率,可采取的措施有减小压强,或升高温度或从平衡混合物中分离出PCl3、Cl2等措施。(4)由于起始时向容器中充入0.5mol PCl5和a mol Cl2,而且平衡时PCl5的转化率仍为20%,则达到平衡时n(PCl5)=0.4mol;n(PCl3)=0.1mol;n(Cl2)= (0.1+a)molc(PCl5)=" 0.2mol/L," c(PCl3) =0.05mol/Lc(Cl2)="(0.1+a)/2L" 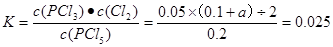 .解得a=0.1mol。(5)在热水中,五氯化磷完全水解,生成磷酸(H3 PO4)的化学方程式是PCl5+4H2O = H3PO4+5HCl。若将0.01 mol PCI5投入l L热水中则产生的Cl-的浓度为c(Cl-)=0.05mol/L,而H3PO4是弱电解质,c(PO43-) <<0.01mol/L. 所以再逐滴加入AgNO3溶液首先要产生AgCl沉淀。(6)根据题意可得方程式为:3P4 + 20HNO3 + 8H2O = 12H3PO4 + 20NO↑
.解得a=0.1mol。(5)在热水中,五氯化磷完全水解,生成磷酸(H3 PO4)的化学方程式是PCl5+4H2O = H3PO4+5HCl。若将0.01 mol PCI5投入l L热水中则产生的Cl-的浓度为c(Cl-)=0.05mol/L,而H3PO4是弱电解质,c(PO43-) <<0.01mol/L. 所以再逐滴加入AgNO3溶液首先要产生AgCl沉淀。(6)根据题意可得方程式为:3P4 + 20HNO3 + 8H2O = 12H3PO4 + 20NO↑
本题难度:一般
5、选择题 下列措施能减慢化学反应速率的是( )
A.烧煤时将煤块粉碎
B.将食物贮藏在冰箱中
C.用过氧化氢溶液制氧气时添加少量二氧化锰粉末
D.用相同质量的锌粉替代锌粒与同浓度同体积的盐酸反应制氢气
参考答案:A、烧煤时将煤块粉碎,增大接触面积,能加快反应速率.故A错误;
B、将食物贮藏在冰箱中,温度降低,能减慢反应速率.故B正确;
C、二氧化锰粉末作催化剂,能加快过氧化氢溶液制氧气的反应速率.故C错误;
D、锌粉替代锌粒,接触面积增大,加快生成氢气的反应速率.故D错误;
故选B.
本题解析:
本题难度:简单