1、推断题 有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。

请回答下列问题:
(1)反应①的化学方程式为_________________________________。
(2)反应②的离子方程式为_________________________________。
(3)写出另外一种实验室制取H的化学方程式________________________________。
(4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10-9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10-2mo1/L ,则生成沉淀所需Pb(NO3)2溶液的最小浓度为________________。
参考答案:(1)4HCl(浓) + MnO2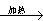 MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O
(2)6I-+ClO3-+6H+=3I2+Cl-+3H2O
(3)2H2O2 2H2O+O2↑(也可用高锰酸钾加热分解)
2H2O+O2↑(也可用高锰酸钾加热分解)
(4)5.6×10-4 mol·L-1
本题解析:
本题难度:一般
2、填空题 (8分)A、B、C、D、E、F、G七种物质中,其中A、D、E为单质,且D、E为气态,G为液态,它们之间存在如下转化关系:
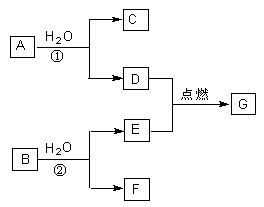
(1)当A、B的质量相等时,生成的D和E恰好完全反应,则C的电子式是?;反应②的离子方程式是 ?。
?。
(2)当A、B的质量比为38:21时,生成的D和E的物质的量之比为1:2,且恰好完全反应,则B的电子式为?;反应①的化学方程式是??。
参考答案:

本题解析:略
本题难度:一般
3、选择题 已知甲、乙、丙三种物质均含有同一种短周期元素,其中甲为单质,其转化关系如下:
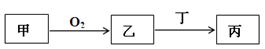
下列说法不正确的(? )
A.若丙既具有漂白性又具有氧化性,则丁可能是Cl2
B.若甲是某种金属,则丁可能是盐酸,也可能是氢氧化钠溶液
C.若甲是某种非金属,且甲和丙反应可以生成乙,则丁可能是Fe
D.若甲是某种非金属,则丙可能是一种用于制备防火材料的物质
参考答案:C
本题解析:甲、乙、丙三种物质均含有同一种短周期元素,则均含有甲单质中的元素,在A项,甲可能是氢气,乙是水,丙是次氯酸,可以;B项若甲是铝,乙是氧化铝,丁可能是盐酸,生成的是氯化铝,也可能是氢氧化钠溶液,生成的是偏铝酸钠;C项若甲是某种非金属,乙是非金属氧化物,甲和丙反应可以生成乙,说明丙的化合价最高,乙处于中间价态,但是乙与铁反应化合价不可能提高,则丁不可能是Fe。D项若甲是硅,乙是二氧化硅,则丙是硅酸钠,可以。
点评:对于常见的单质及其氧化物的性质进行了全面考查,难度不大,但是综合性较强,同时考查了反应的规律性。
本题难度:一般
4、填空题 (10分)有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复) 提示:CH3COONH4溶液为中性
阳离子
| Na+、Ba2+、NH4+
|
阴离子
| CH3COO-、Cl-、OH-、SO42-
|
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A是______ ,B是_______ ,C是_______ ,D是________ 。
(2)用离子方程式表示A的水溶液显碱性的原因________________________________。
(3)25℃时,0.1mol·L-1 B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)= _______(用含a的关系式表示)。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为____________?_______。
参考答案:(1)CH3COONa、NH4Cl、Ba(OH)2、Na2SO4(各1分)?(2)CH3COO- + H2O  ?CH3COOH + OH-(2分)(3)1×10(a-14)(2分)?(4)c(OH-)> c(Ba2+) = c(Cl-)> c(NH4+)> c(H+)?(2分)
?CH3COOH + OH-(2分)(3)1×10(a-14)(2分)?(4)c(OH-)> c(Ba2+) = c(Cl-)> c(NH4+)> c(H+)?(2分)
本题解析::①A、C溶液的pH均大于7,应为醋酸盐和碱溶液,A、B的溶液中水的电离程度相同,则溶液水解程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象,则说明C为Ba(OH)2,D为Na2SO4,则B为NH4Cl
(1)根据题中信息推断出各物质分别为:A.CH3COONa,B.NH4Cl,C.Ba(OH)2,D.Na2SO4;
(2)醋酸钠水解呈碱性,离子方程式为CH3COO- + H2O  ?CH3COOH + OH-
?CH3COOH + OH-
(3)在氯化铵中,存在电荷守恒:c(OH—)+ c(Cl—)=c(NH4+)+c(H+),存在原子守恒:c(Cl—)=c(NH4+)+ c(NH3·H2O);根据两个等式可以得出c(H+)-c(NH3·H2O)= c(OH—)=1×10(a-14)
(4)等体积、等物质的量浓度的NH4Cl和Ba(OH)2混合反应后溶液中溶质是BaCl2、Ba(OH)2、NH3?H2O,则c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+),
点评:题目较为综合,难度较大,正确推断各种物质为解答本题的关键。
本题难度:一般
5、填空题 A、B、C、D、E、F六神物质的相互转化关系如下图所示(反应条件末标出),其中反应①是置换反应.
(1)若A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是:______.
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是:______;A元素在于周期表中的位置是______.
(3)若B、C、F都是气态单质,且B有毒;③和④两个反应中都有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,则该白烟物质的电子式是______,反应③的化学方程式是______.
(4)若A、D为短周期元素单质,且A为固体金属单质,D为固体非金属单质,③和④两个反应中都有红棕色气体生成,则反应④的化学方程式是:______.
参考答案:(1)A+B=C+D是置换反应,AD为同主族,判断为A为C,B为SiO2,A、F所含元素同周期,C+F=E,A+F=E,D+F=B,判断F为O2;反应①的化学方程式为:2C+SiO2?高温?.?2CO+Si;
故答案为:2C+SiO2?高温?.?2CO+Si;
(2)A+B=C+D是置换反应,A为金属,D、F是气态单质,反应①在水溶液中进行,C+F=E,A+F=E,D+F=B说明A元素具有变价,判断A为Fe,B为HCl,C为FeCl2,F为Cl2;反应②(在水溶液中进行)的离子方程式是:2Fe+Cl2=2Fe3+;A元素在于周期表中的位置为:第四周期,第ⅤⅢ族;
故答案为:2Fe+Cl2=2Fe3+;第四周期,第ⅤⅢ族;
(3)A+B=C+D是置换反应,B、C、F都是气态单质,且B有毒判断为Cl2;A、D相遇有白烟生成,A为 NH3,D为HCl,白烟为氯化铵;反应②需要放电才能发生判断C为N2,F为O2,E为NO;上述推断符合③和④两个反应中都有水生成;该白烟物质的电子式为:
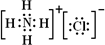
;反应③的化学方程式为:4NH3+O2催化剂.△4NO+6H2O;
故答案为:
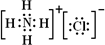
;4NH3+O2催化剂.△4NO+6H2O;
(4)A+B=C+D是置换反应,若A、D为短周期元素单质,且A为固体金属单质,D为固体非金属单质,③和④两个反应中都有红棕色气体生成,非金属单质D为C,F为浓硝酸,金属置换非金属单质的反应应为镁和二氧化碳反应生成氧化镁和碳的反应,判断A为Mg;B为CO2;C为MgO;D为C;E为Mg(NO3)2;F为NHO3;反应④的化学方程式为:C+4HNO3?△?.?4NO2↑+CO2↑+2H2O;
故答案:C+4HNO3?△?.?4NO2↑+CO2↑+2H2O;
本题解析:
本题难度:一般