1、实验题 某同学在用稀盐酸与锌制取氢气的实验中,发现加入少量氯化铜溶液可加快氢气的生成速率。
请回答下列问题:
(1)要加快上述实验中气体产生的速率,还可采取的措施有____________________(答两种);
(2)实验室中现有NaCl、CuSO4、FeCl2、ZnCl2等4种溶液,可与实验中CuCl2溶液起相似作用的是
_______________________________;
为了进一步研究氯化铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。

(3)请完成此实验设计,其中:V1=_________,V6=_________,V9=_________;
(4)该同学最后得出的结论为:当加入少量CuCl2溶液时,生成氢气的速率会大大提高。但当加入的
CuCl2溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_________________________________________________
2、实验题 硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时必需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
【甲方案】如下图所示,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。

(1)洗气瓶C中导管末端连接一个多孔球泡D,其目的是______________________________。
(2)洗气瓶C中的溶液还可以用其他试剂代替,如酸性高锰酸钾溶液,你认为选择酸性高锰酸钾溶液的理由有________________________________________________________。
(3)洗气瓶C中溶液蓝色消失后,若没有及时关闭活塞A,则测得的SO2含量____________(填“偏高”、“偏低”或“无影响”)。若某实验小组同学测得的SO2含量总是偏低,可能的原因是__________________________________________________。(假设实验装置、测量仪器、药品和实验操作程序均合理)
【乙方案】:实验步骤如下面流程图所示:

(4)写出步骤②中反应的化学方程式____________________________________________。
(5)步骤③中判断沉淀已经洗涤干净的方法是_______________________________________。
(6)实验中若通过的尾气体积为33.6L (已换算成标准状况),最终所得固体质量为0.233g,试通过计算确定该尾气中二氧化硫的含量是否达到排放标准(写出计算过程)。
3、实验题 如图是实验室制备SO2并验证SO2某些性质的装置图。试回答:
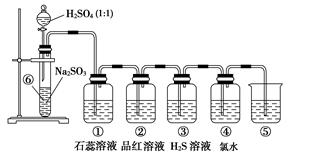
(1)⑥中发生的化学反应方程式为______________________________________(2分)
(2)⑤的作用是_______________________________________________________(2分),
反应的离子方程式为___________________________________________________(2分)
(3)填表格(每空1分)
E.读滴定管开始时仰视,读终点时俯视
5、实验题 (15分)某化学研究小组探究无水三草酸合铁酸钾K3[Fe(C2O4)3]受热分解的产物,并对所得气体产物和固体产物进行验证,按下图装置进行实验(夹持仪器已略去)。

(1)连接好装置后,加入药品前,应该进行的实验操作是________________(填操作名称)。
(2)实验开始时缓缓通入氮气,过一段时间以后,加热反应管A和E ,待反应完全后,停止加热,仍继续通氮气,直到反应管冷却。停止加热前是否需要先断开A、B的连接处和E、F的连接处?为什么?_______________________________________________________________。
(3)实验中观察到B中澄清石灰水变浑浊,则说明气体产物中有?(写化学式)。
能证明分解产物中有CO气体生成的实验现象是?。
(4)该小组同学查阅资料后得知,固体产物中不存在+3价Fe元素,而盐类物质只有K2CO3。
① 验证固体产物中钾元素存在的方法是?,现象是?。
② 研究小组为探究铁元素的存在形式,取A中充分反应后所得固体于试管中,加入足量蒸馏水,过滤、洗涤、干燥得到黑色粉末,取4.4g黑色粉末溶于足量稀硝酸中,收集到标准状况下NO气体1.12L通过计算判断黑色粉末的成分为?(写化学式)。写出黑色粉末溶于足量稀硝酸发生反应的离子方程式?。