1、选择题 钾和钠的性质相似,下列说法中能较好地解释这个事实的是( )
A.都是金属元素
B.最外层电子数相同
C.原子半径相差不大
D.最高化合价相同
参考答案:A.金属元素有很多种,但性质不完全相似,只有位于同一主族的元素,性质才相似,故A错误;
B.钠和钾都位于周期表第Ⅰ主族,最外层电子数相同,性质相似,故B正确;
C.同主族原子半径相差较大,但性质相似,同周期元素原子半径相差不大,但性质不同,故C错误;
D.化合价相同的元素性质不一定相同,如Mg、Cu最高化合价都为+2价,但性质不同,故D错误.
故选B.
本题解析:
本题难度:简单
2、简答题 A、B、C、D都是短周期元素,原子半径:D>C>A>B.已知:A、B同周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是D原子最外层电子数的3倍.试回答:
(1)写出元素的名称:A______、C______.
(2)写出由B、D组成的两种化合物的电子式分别为:______、______.
(3)C的固态氧化物属于______晶体.写出表示C的氧化物的一种重要的工业用途______.
(4)A、C的最高价氧化物对应水化物中酸性较强的是______(写水化物的分子式).
(5)写出C的氧化物与D的最高价氧化物对应水化物反应的离子方程式______.
参考答案:由A、C同主族,原子半径C>A,则A、C电子数相差8,C原子核内的质子数等于A、B原子核内的质子数之和,推出B原子的质子数为8,即B为O元素,C为第三周期元素,由C原子最外层电子数是D原子最外层电子数的3倍,若D最外层为1个电子,则C最外层为3个电子,若D最外层是2个电子,则C最外层是6个电子,则C与B是同主族元素了,不符合题意,故C为Al元素,D为Na元素,A为B元素,
(1)A为B元素,C为Al元素,故答案为:硼;铝;
(2)由B、D组成的两种化合物分别为Na2O、Na2O2,都属于离子化合物,电子式分别为
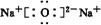
、
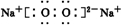
,
故答案为:
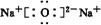
;
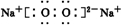
;
(3)C为Al元素,对应的氧化物为Al2O3,为离子化合物,熔点高、硬度大,常用作耐火材料,也常用于电解冶炼铝的原料,故答案为:离子;作耐火材料或电解冶铝;
(4)A、C的最高价氧化物对应水化物分别为H3BO3、Al(OH)3,其中H3BO3为一元酸,Al(OH)3为两性氢氧化物,酸性强的是H3BO3,故答案为:H3BO3;
(5)Al2O3为两性氧化物,能与NaOH溶液反应,反应的离子方程式为,故答案为:Al2O3+2OH-+3H2O═2[Al(OH)4]-.
本题解析:
本题难度:一般
3、填空题 现有甲、乙两种元素,第3周期元素甲最外层有2个电子,元素乙3p能级上的电子排布方式为

(1)写出甲、乙两元素的符号:甲_______,乙_______。
(2)甲、乙两元素形成的单质加热反应后的产物是_____,其为_______ (填“离子”或“共价”)化合物,它们发生反应的化学方程式为_________________。
参考答案:(1)Mg;S
(2)MgS;离子;Mg+S MgS
MgS
本题解析:
本题难度:一般
4、选择题 A、B、C、D都是周期表中前20号元素,已知A的阳离子和C的阴离子具有相同的核外电子排布,且能形成组成为AC的化合物;C和D属同主族,其中C的核外电子数是D的核内质子数的2倍.B和D是同周期元素且A和B能形成AB2型化合物.下列说法中正确的是( )
A.D元素处于元素周期表中第二周期Ⅵ族
B.BC2分子一定是极性分子
C.AB2中可能既有离子键又有共价键
D.四种元素的原子半径大小一定是A>C>D>B
参考答案:解;C和D属同主族,其中C的核外电子数是D的核内质子数的2倍,则C为S元素,D为O元素,A的阳离子和C的阴离子具有相同的核外电子排布,且能形成组成为AC的化合物,则A在周期表第四周期,第ⅡA族,应为Ca元素,B和D是同周期元素且A和B能形成AB2型化合物,则B为C元素或F元素,形成的化合物为CaF2或CaC2,
A、D为O元素,处于元素周期表中第二周期ⅥA族,故A错误;
B、若BC2分子为CS2,为直线形分子,结构对称,是非极性分子,故B错误;
C、如AB2是CaC2,则既有离子键又有共价键,故C正确;
D、如B是C元素,则四种元素的原子半径大小顺序是A>C>B>D,故D错误.
故选C.
本题解析:
本题难度:一般
5、简答题 A、B、C、D是四种短周期元素,E、F是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图为: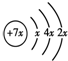 ,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E、F的外围电子排布式分别为3d54s1,3d64s2,回答下列问题:
,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E、F的外围电子排布式分别为3d54s1,3d64s2,回答下列问题:
(1)A的基态原子的电子排布式是______;
(2)B的最高价氧化物的化学式为______,C的最低负化合价为______.
(3)用轨道表示式表示D原子核外电子排布______;
(4)解释为什么E的外围电子排布式为3d′54s1,而不为3d44s2?______;
(5)F原子结构示意图是______.
参考答案:A、B、C、D是四种短周期元素,A的原子结构示意图为: ,x=2,故A为Si元素,A、B、C同周期,处于第三周期,B是同周期除稀有气体外半径最大的元素,B为Na元素,C的最外层有三个成单电子,外围电子排布为3s23p3,故C为P元素,C、D同主族,故D为N元素,E、F是过渡元素,E、F的外围电子排布式分别为3d54s1,3d64s2,故E为Cr元素,F为Fe元素,
,x=2,故A为Si元素,A、B、C同周期,处于第三周期,B是同周期除稀有气体外半径最大的元素,B为Na元素,C的最外层有三个成单电子,外围电子排布为3s23p3,故C为P元素,C、D同主族,故D为N元素,E、F是过渡元素,E、F的外围电子排布式分别为3d54s1,3d64s2,故E为Cr元素,F为Fe元素,
(1)A为Si元素,原子核外电子数为14,基态原子的电子排布式是:1s22s22p63s23p2,故答案为:1s22s22p63s23p2;
(2)B为Na元素,最高价氧化物的化学式为:Na2O;C为P元素,最外层电子数为5,最低负化合价为-3,故答案为:Na2O;-3;
(3)D为N元素,原子核外电子数为7,核外电子轨道表示为: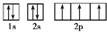 ,故答案为:
,故答案为: ;
;
(4)E的外围电子呈3d′54s1时,3d、4s轨道上的电子处于半满状态,整个体系的能量最低,故么E的外围电子排布式为3d′54s1,而不为3d44s2;
故答案为:E的外围电子呈3d′54s1时,3d、4s轨道上的电子处于半满状态,整个体系的能量最低;
(5)F为Fe元素,是26号元素,Fe原子结构示意图是: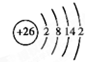 ,故答案为:
,故答案为: .
.
本题解析:
本题难度:一般