1、填空题 已知1 mol CuSCN在下列反应中失去7 mol电子,完成并配平下列化学反应方程式:CuSCN+KMnO4+H2SO4——HCN+CuSO4+MnSO4+K2SO4+H2O
参考答案:10CuSCN+14KMnO4+21H2SO4====10HCN+10CuSO4+14MnSO4+7K2SO4+16H2O
本题解析:观察反应前后Mn的化合价变化:
设CuSCN的化学计量数为x,KMnO4的化学计量数为y,根据得失电子的总数相等,则7x=5y,即x∶y=5∶7,代入后用观察法确定其他物质的化学计量数,最后使各项化学计量数变为整数,得:10、14、21、10、10、14、7、16。
本题难度:简单
2、选择题 下列有关氧化还原反应的说法正确的是
A.浓盐酸在化学反应中既可以做氧化剂,又可以作还原剂
B.工业上常以SiO2为原料制取粗硅,这一过程中,硅元素被氧化
C.在任何条件下都不能发生反应:Cu + H2SO4=CuSO4+ H2↑
D.亚氯酸可发生分解反应:HClO2 → ClO2↑ + Cl2+ H2O(未配平),1 mol HClO2分解时,转移电子的物质的量为1 mol
参考答案:A
本题解析:B、硅由+4价变为0价,化学价降低,被还原,故错;C、在电解池中可以反应,故错;D、应为3/4mol,故错。故选A。
点评:本题考查氧化还原反应,明确还原剂、氧化剂中元素的化合价变化是解答本题的关键,并熟悉常见的氧化还原反应来解答。
本题难度:一般
3、填空题 实验室常用高锰酸钾与浓盐酸反应制取氯气:KMnO4+HCl——KCl+MnCl2+Cl2↑+H2O,其中还原剂是_________。若消耗0.1 mol氧化剂,则被氧化的还原剂的物质的量是_________mol。若需2.24 L(标准状况)氯气,反应中消耗盐酸的物质的量为_________mol,转移的电子数是_________mol。
参考答案:HCl? 0.5? 0.32? 0.2
本题解析:2KMnO4+16HCl====2KCl+2MnCl2+5Cl2+8H2O,还原剂只占HCl总量的 。
。
本题难度:简单
4、选择题 NaNO2有像食盐一样的外观和咸味,它可将正常的血红蛋白变为高铁血红蛋白,使血红蛋白中的铁元素由二价变为三价,失去携氧能力,美蓝是亚硝酸盐中毒的有效解毒剂。
(1)下列说法正确的是_________(填序号)。
A.解毒剂美蓝应该具有氧化性? B.中毒时亚硝酸盐发生氧化反应
C.解毒时高铁血红蛋白被还原? D.中毒过程中血红蛋白显氧化性
(2)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O从上述反应推知________(填序号)。
A.氧化性:I2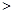 NaNO2?B.氧化性:NaNO2
NaNO2?B.氧化性:NaNO2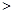 I2
I2
C.还原性:HI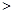 NO? D.还原性:I2
NO? D.还原性:I2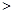 HI
HI
(3)根据上述反应,可用试纸和生活中常见的物质进行实验来鉴别NaNO2和NaCl。现供选用的物质有:①白酒?②碘化钾淀粉试纸?③淀粉?④白糖?⑤食醋,进行本实验时,可以选用的物质至少有__________(填序号)。
(4)某工厂的废液中含有2%~5%的NaNO2,直接排放会造成污染。下列试剂中:①NaCl②NH4Cl?③HNO3?④浓H2SO4,能使NaNO2转化为N2的是_______(填序号)。
参考答案:(1)C(2分)
(2)BC(2分,选对一个得1分,错选一个倒扣一分)
(3)②⑤(全对得2分)
(4)②(2分)
本题解析:(1)NaNO2使人中毒的原因是:NaNO2把Fe2+氧化为Fe3+,NaNO2发生了还原反应,血红蛋白显示了还原性,故B、D项错误;美蓝解毒时把Fe3+还原为Fe2+,美蓝具有还原性,所以A项错,C项正确。
(2)在同一氧化还原反应中,氧化性强弱顺序为:氧化剂>氧化产物;还原性强弱顺序为:还原剂>还原产物,所以BC项正确。
(3)根据(2)中化学反应,NaNO2在酸性条件下可将I?氧化为I2,所以②⑤即可鉴别NaNO2与NaCl。
(4)NaNO2转化为N2,NaNO2作氧化剂,需要加入还原剂,故选②NH4Cl。,,,
本题难度:一般
5、选择题 对于Fe+2HCl=FeCl2+ H2↑反应,下列说法不正确的是(?)
A.Fe是还原剂,被氧化
B.HCl是氧化剂,发生了还原反应
C.-1价氯在反应中价态未变,所以HCl既不是氧化剂,又不是还原剂
D.此反应既是置换反应又是氧化还原反应
参考答案:C
本题解析:A 正确,铁的化合价升高,失电子,是还原剂,被氧化。
B 正确,氢元素化合价降低,得电子,是氧化剂,被还原,发生了还原反应。
C 错误,HCl是还原剂。
D 正确,既是氧化反应也是置换反应。
故选C
本题难度:一般