1、选择题 已知中学化学中常见反应形式为: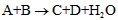 ,对于该反应的下列叙述不正确的是
,对于该反应的下列叙述不正确的是
[? ]
A.该反应可能是氧化还原反应
B.该反应可能是非氧化还原反应
C.C和D有一种一定是盐
D.A和B不一定是酸或碱
参考答案:C
本题解析:
本题难度:简单
2、填空题 氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)水是人体的重要组成成分,是人体中含量最多的一种物质。而“四种基本反应类型
与氧化还原反应的关系”也可用如图表达。
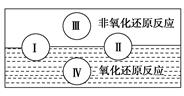
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:________________________,其中水为________剂。
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
CuO+____NH4Cl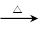 Cu+____CuCl2+N2↑+____H2O。
Cu+____CuCl2+N2↑+____H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是________(填元素名称),氧化剂是________(填化学式)。
(3)(2011·福建高考卷节选)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10,10C+P4O10=P4+10CO。
每生成1 mol P4时,就有________mol电子发生转移。
参考答案:(1)C+H2O(g) CO+H2(合理即可) 氧化
CO+H2(合理即可) 氧化
(2)①4CuO+2NH4Cl 3Cu+CuCl2+N2↑+4H2O
3Cu+CuCl2+N2↑+4H2O
②氮 CuO (3)20
本题解析:(1)由图可知,反应类型Ⅳ全部属于氧化还原反应,应该是置换反应,有水参加的置换反应有许多,如C+H2O(g)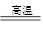 ?CO+H2、2Na+2H2O=2NaOH+H2↑等上述两个反应中水均作氧化剂。
?CO+H2、2Na+2H2O=2NaOH+H2↑等上述两个反应中水均作氧化剂。
(2)①用化合价升降法配平化学方程式为4CuO+2NH4Cl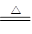 ?3Cu+CuCl2+N2↑+4H2O。
?3Cu+CuCl2+N2↑+4H2O。
②在该反应中,氮元素化合价升高,被氧化,NH4Cl为还原剂,铜元素化合价降低,被还原,CuO为氧化剂。
(3)反应过程中磷酸钙最终变成了白磷,磷的化合价由+5价变成0价,由此可以得到如下关系式:
2Ca3(PO4)2~P4~20e-,所以每生成1 mol P4,转移20 mol电子。
本题难度:一般
3、选择题 已知反应:①Cl2+2KBr=2KCl+Br2, ②KClO3 +6HCl=3Cl2+KCl +3H2O,
③2KBrO3 +Cl2=Br2 + 2KClO3,下列说法正确的是
A.上述三个反应都有单质生成,所以都是置换反应
B.氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2
C.反应②中还原剂与氧化剂的物质的量之比为6:1
D.③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol
参考答案:B
本题解析:A.②中生成物有单质但反应物没有单质,所以不是置换反应,A错误;B.①Cl2+2KBr=2KCl+Br2中氧化剂是氯气,氧化产物是溴,氯气的氧化性大于溴,②KClO3+6HCl=3Cl2+KCl+3H2O中氧化剂是氯酸钾,氧化产物是氯气,氯酸钾的氧化性大于氯气,③2KBrO3+Cl2=Br2+2KClO3中氧化剂是溴酸钾,氧化产物是氯酸钾,溴酸钾的氧化性大于氯酸钾,所以,氧化性强弱顺序是 KBrO3>KClO3>Cl2>Br2,B正确;C.②KClO3+6HCl=3Cl2+KCl+3H2O中,氧化剂是氯酸钾,还原剂是参加反应氯化氢的 ,所以还原剂和氧化剂的物质的量之比是5:1,C错误;D.③还原剂是氯气,氧化剂是溴酸钾,该反应式中lmol还原剂反应则氧化剂得到电子的物质的量=2×(5-0)mol=10mol,D错误;
,所以还原剂和氧化剂的物质的量之比是5:1,C错误;D.③还原剂是氯气,氧化剂是溴酸钾,该反应式中lmol还原剂反应则氧化剂得到电子的物质的量=2×(5-0)mol=10mol,D错误;
本题难度:一般
4、选择题 下列叙述正确的是
[? ]
A.分解反应一定是氧化还原反应
B.氧化还原反应的特征:化合价发生变化
C.还原剂就是反应中被还原的物质
D.在氧化还原反应中,失去电子的元素化合价降低
参考答案:B
本题解析:
本题难度:简单
5、选择题 用0.1 mol·L-1的Na2SO3溶液30 mL恰好将2×10-3 mol的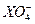 还原,则元素X在还原产物中的化合价是(?)
还原,则元素X在还原产物中的化合价是(?)
A.+1
B.+2
C.+3
D.+4
参考答案:D
本题解析:硫元素化合价升高的总数等于X元素化合价降低的总数,则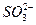 中
中 ,
,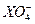 中
中
0.1×30×10-3×2=2×10-3×(7-a),a=4。
本题难度:简单