1、选择题 在已达到平衡的可逆反应2SO2+O2 2SO3中,充入由18O组成的氧气一段时间后,18O存在于下列物质中的(? )
2SO3中,充入由18O组成的氧气一段时间后,18O存在于下列物质中的(? )
A.多余的氧气中
B.生成的三氧化硫中
C.氧气和二氧化硫中
D.二氧化硫、氧气和三氧化硫中
参考答案:D
本题解析:化学平衡是动态平衡,18O2的加入定会与SO2结合生成含18O的SO3,同时含18O的SO3又会分解得到SO2和O2,使SO2、O2中也含有18O,因此18O存在于SO2、O2、SO3这三种物质中。
本题难度:简单
2、选择题 某温度下,已知反应mX(g)+nY(g) qZ(g)?ΔH>0,m+n>q,在体积一定的密闭容器中投入反应物达到平衡,下列叙述正确的是(? )
qZ(g)?ΔH>0,m+n>q,在体积一定的密闭容器中投入反应物达到平衡,下列叙述正确的是(? )
A.通惰性气体增大压强,平衡正向移动
B.再加入X,反应吸收的热量增大
C.增加Y的物质的量,X的转化率减小
D.降低温度,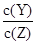 的值变小
的值变小
参考答案:B
本题解析:A错,体积一定的密闭容器中的可逆反应达到平衡时,再通惰性气体增大压强,体系内气体各组分浓度不变,平衡不移动;B正确,该反应的正反应方向为吸热反应,加入反应物,平衡向正反应方向移动,反应吸收的热量增大;C错,增加Y的物质的量,X的转化率增大;D错,降低温度,平衡左移,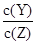 的值变大;
的值变大;
本题难度:一般
3、选择题 现有反应X(g)+Y(g) 2Z(g)△H<0。下图表示从反应开始到t
2Z(g)△H<0。下图表示从反应开始到t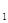 s时达到平衡,在t
s时达到平衡,在t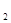 s时由于条件变化使平衡破坏,到t
s时由于条件变化使平衡破坏,到t s时又达平衡。则在图中t
s时又达平衡。则在图中t s时改变的条件可能是
s时改变的条件可能是

A.增大压强
B.使用了催化剂
C.降低温度
D.减小了X或Y的浓度
参考答案:C
本题解析:从图像可知从t2开始反应物的浓度继续减小,产物的浓度继续增大,反应达平衡的时间增大,所以平衡正向移动且速率减小,因此答案选C。
点评:在分析有关图像时应该注意:一、ν-t 图像或 c-t 图像:1.ν-t 图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率和平衡移动的影响。?二、平衡图像 1.出现拐点的图像:分析依据“先拐先平”。在转化率-时间图像或物质的百分含量-时间图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂等)。
本题难度:一般
4、填空题 化学反应原理在科研和生产中有广泛应用
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应TaS2(s)+2I2(g) TaI4(g)+S2(g)? △H﹥0?(Ⅰ)反应(Ⅰ)的平衡常数表达式K=?,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 ?,
TaI4(g)+S2(g)? △H﹥0?(Ⅰ)反应(Ⅰ)的平衡常数表达式K=?,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 ?,
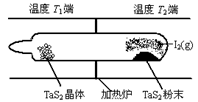
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1?T2(填“﹥”“﹤”或“=”)。上述反应体系中循环使用的物质是?。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化为 H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为?,滴定反应的离子方程式为?,
(4)25℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh=?mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh=?mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中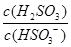 将?(填“增大”“减小”或“不变”)。
将?(填“增大”“减小”或“不变”)。
参考答案:
(1) ;66.7%;
;66.7%;
(2)<; I2;
(3)淀粉; H2SO3+I2+H2O=2I-+SO42-+4H+;
(4)1.0×10-12;增大。
本题解析:
(1)根据题给的化学方程式:TaS2(s)+2I2(g) TaI4(g)+S2(g),可知K=
TaI4(g)+S2(g),可知K= ;由于K=1,设平衡时TaI4和S2的物质的量为x,则根据平衡常数可列式:(x/V)2=【(1-2x)/V】2,即:x2=(1-2x)2,解得x=1/3,故I2(g)的平衡转化率为:(2/3)×100%=66.7%;
;由于K=1,设平衡时TaI4和S2的物质的量为x,则根据平衡常数可列式:(x/V)2=【(1-2x)/V】2,即:x2=(1-2x)2,解得x=1/3,故I2(g)的平衡转化率为:(2/3)×100%=66.7%;
(2)分析题给的化学方程式:TaS2(s)+2I2(g) TaI4(g)+S2(g)? △H﹥0,该反应正向吸热;由于反应先在T2端开始,一段时间后在T1端得到晶体,说明反应生成的气体在T1端温度降低平衡左移,故温度T1<T2;在上述变化过程中I2可以循环使用;
TaI4(g)+S2(g)? △H﹥0,该反应正向吸热;由于反应先在T2端开始,一段时间后在T1端得到晶体,说明反应生成的气体在T1端温度降低平衡左移,故温度T1<T2;在上述变化过程中I2可以循环使用;
(3)利用I2的氧化性可测定钢铁中硫的含量时的指示剂是淀粉,反应的离子方程式为:H2SO3+I2+H2O= 2I-+SO42-+4H+;
(4)根据NaHSO3的水解方程式:HSO3-+H2O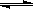 H2SO3+OH-,其水解平衡常数的表达式为:Kh=c(H2SO3)×c(OH-)/c(HSO3-),故Ka×Kh= c(H+)×c(OH-)=Kw,可求出Kh =1.0×10-12;若向NaHSO3溶液中加入少量的I2,溶液中发生反应:HSO32-+I2+H2O=SO42-+2I-+3H+,氢离子结合氢氧根离子,使平衡向右移动,造成溶液中
H2SO3+OH-,其水解平衡常数的表达式为:Kh=c(H2SO3)×c(OH-)/c(HSO3-),故Ka×Kh= c(H+)×c(OH-)=Kw,可求出Kh =1.0×10-12;若向NaHSO3溶液中加入少量的I2,溶液中发生反应:HSO32-+I2+H2O=SO42-+2I-+3H+,氢离子结合氢氧根离子,使平衡向右移动,造成溶液中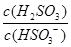 增大。
增大。
【考点定位】此题综合考查了化学平衡常数、电离平衡常数和水解平衡常数、平衡转化率、化学平衡的移动、滴定指示剂的选择等知识。
本题难度:一般
5、简答题 在100℃时,将0.100mol的N2O4气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如表格:
时间/s
浓度mol?L-1 | 0 | 20 | 40 | 60 | 80 | 100
c(N2O4)mol?L-1
0.100
c1
0.050
c3
a
b
c(NO2)/mol?L-1
0.000
0.060
c2
0.120
0.120
0.120
|
试填空:
(1)达到平衡时N2O4的转化率为______%,表中c2______c3,a______b?(选填“>”“<”“=”).
(2)20s的四氧化二氮的浓度c1=______mol?L-1,在0s~20s内四氧化二氮的平均反应速率为______mol?(L?s)-1;.
(3)若在相同情况下最初向该容器充入的是二氧化氮气体要达到上述同样的平衡状态,二氧化氮的起始浓度是______mol?L-1.
参考答案:(1)由表可知,60s时反应达平衡,c(NO2)=0.120mol/L,
?N2O4?
?2 NO2,
浓度变化:0.06mol/L? 0.120mol/L
所以平衡时N2O4的转化率为0.06mol/L0.1mol/L×100%=60%;
c3=0.1mol/L-0.06mol/L=0.04mol/L,
由表可知,40s时,c(N2O4?)=0.050mol/L,
? N2O4?
? ?2 NO2,
浓度变化:(0.1-0.05)mol/L? 0.10mol/L
所以c2=0.10mol/L
所以c2>c3;
60s后反应达平衡,反应混合物各组分的浓度不变,所以a=b.
故答案为:60;>;=
(2)由表可知,20s时,c(NO2?)=0.060mol/L,所以
? N2O4?
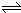
? ?2 NO2,
浓度变化:0.03mol/L? 0.060mol/L
所以20s的四氧化二氮的浓度c1=0.1mol/L-0.03mol/L=0.07mol/L;
在0s~20s内四氧化二氮的平均反应速率为v(N2O4)=0.03mol/L20s=0.0015mol?(L?s)-1.
故答案为:0.07mol/L;0.0015mol?(L?s)-1.
(3)达到上述同样的平衡状态,为等效平衡,按化学计量数换算到N2O4一边,满足c(N2O4)为0.100mol/L.
所以? N2O4?
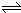
? ?2 NO2,
?0.1mol/L? 0.20mol/L
故答案为:0.20mol/L
本题解析:
本题难度:一般