1、计算题 对于CO(g)+H2O(g) CO2(g)+H2(g),起始时只有CO、H2O(g)且浓度都是4 mol·L-1,达到平衡时,CO的浓度为1 mol·L-1;将H2O(g)的浓度提高到3 mol·L-1,平衡时CO的浓度为0.53 mol ·L-1。求:两次平衡时CO、H2O的转化率和CO2在平衡混合物中百分含量。
CO2(g)+H2(g),起始时只有CO、H2O(g)且浓度都是4 mol·L-1,达到平衡时,CO的浓度为1 mol·L-1;将H2O(g)的浓度提高到3 mol·L-1,平衡时CO的浓度为0.53 mol ·L-1。求:两次平衡时CO、H2O的转化率和CO2在平衡混合物中百分含量。
参考答案:CO转化率=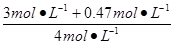 ×100%=86.75%,
×100%=86.75%,
H2O(g)转化率= ×100%=57.8%,
×100%=57.8%,
w(CO2)=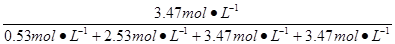 ×100%=34.7%。
×100%=34.7%。
。
本题解析:第一次平衡过程:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度/mol·L-1? 4? 4? 0? 0
转化浓度/mol·L-1? 3? 3? 3? 3
平衡浓度/mol·L-1? 1? 1? 3? 3
CO转化率=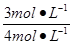 ×100%=75%,
×100%=75%,
H2O(g)转化率=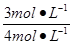 ×100%=75%,
×100%=75%,
w(CO2)=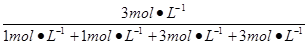 ×100%=37.5%。
×100%=37.5%。
第二次平衡过程:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度/mol·L-1? 1? 3? 3? 3
转化浓度/mol·L-1? 0.47? 0.47? 0.47? 0.47
平衡浓度/mol·L-1? 0.53? 2.53? 3.47? 3.47
CO转化率=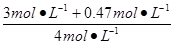 ×100%=86.75%,
×100%=86.75%,
H2O(g)转化率= ×100%=57.8%,
×100%=57.8%,
w(CO2)=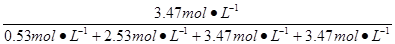 ×100%=34.7%。
×100%=34.7%。
本题难度:简单
2、选择题 下列事实中 ,不能用勒夏特列原理解释的是:?
,不能用勒夏特列原理解释的是:?
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.在FeSO4溶液中加入少量铁粉以防止Fe2+被氧化
C.实验室中常用排饱和食盐水的方法收集Cl2
D.工业上生产硫酸的过程中使用过量的空气以提高SO2的利用率
参考答案:B
本题解析:略
本题难度:简单
3、填空题 (14分) 在温度为373K时,将0.400 mol无色的N2O4气体通入4 L抽空
的密闭容器中,立刻出现红棕色,直至建立N2O4  2NO2?的平
2NO2?的平
衡。右图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,
横坐标为时间)(1)该反应的化学平衡常数表达式为K =?。此温度下,K值=?。
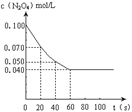
(2)计算在0至20秒时间内,NO2的平均生成速率为?mol?L-1?s-1。
(3)下表是不同温度下测定得到的该反应的化学平衡常数。
据此可推测该反应(生成NO2)是?反应(选填“吸热”或“放热”)。
(4)若其他条件不变,反应在373K时达到平衡后,将N2O4和NO2的浓度都增加至0.4mol/L,平衡将向?(填“正”或“逆”)反应方向移动。
(5) 反应在373K时达到平衡时,N2O4的转化率=_________________,若将反应容器的容积缩小为原来的一半,则N2O4的转化率将_________(选填“增大”,“减小”或“不变”)
参考答案:(1)K = 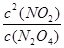 ?;K值= 0.36?。(1)0.003mol?L-1?s-1。
?;K值= 0.36?。(1)0.003mol?L-1?s-1。
(3)?吸热反应(填“吸热”或“放热”)。?(4)向?逆(填“正”或“逆”)反应方向移动。
(5)60%,减小
本题解析:考查可逆反应的有关
(1)在一定条件下,当可逆反应达到化学平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,称为化学平衡常数。所以该反应的平衡常数表达式为K =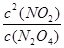 。根据图像可知,平衡时N2O4的浓度为0.040mol/L,起始时N2O4的浓度为0.100mol/L,所以其浓度变化量为0.060mol/L,因此平衡时NO2的浓度为0.12mol/L。所以平衡常数为
。根据图像可知,平衡时N2O4的浓度为0.040mol/L,起始时N2O4的浓度为0.100mol/L,所以其浓度变化量为0.060mol/L,因此平衡时NO2的浓度为0.12mol/L。所以平衡常数为 。
。
(2)根据图像可知,20s时N2O4的浓度为0.070mol/L,所以其浓度变化量为0.030mol/L,因此此时NO2的浓度为0.06mol/L。所以NO2的反应速率为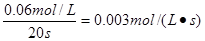 。
。
(3)根据平衡常数的数值可知温度越高,平衡常数越大,所以正反应是吸热反应。
(4)若N2O4和NO2的浓度都是0.4mol/L,则此时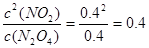 >0.36,这说明此时逆反应速率大于正反应速率,反应向逆反应方向移动。
>0.36,这说明此时逆反应速率大于正反应速率,反应向逆反应方向移动。
(5)根据(1)可知N2O4的转化率为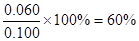 。因为反应是体积增大的可逆反应,所以增大压强,平衡向逆反应方向移动,转化率减小。
。因为反应是体积增大的可逆反应,所以增大压强,平衡向逆反应方向移动,转化率减小。
本题难度:一般
4、填空题 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上利用煤的汽化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的汽化的主要化学方程式为?。
(2)利用水煤气合成二甲醚的总反应式可表示为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) △H< 0。一定条件下得密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是?(填字母代号)。
CH3OCH3(g)+CO2(g) △H< 0。一定条件下得密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是?(填字母代号)。
A.高温高压
B.加入催化剂
C.减少CO2的浓度
D.增加CO的浓度 E.分离出二甲醚
 CH3OCH3(g)+H2O(g),某温度下得平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g),某温度下得平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下: