1、选择题 t℃时,在一密闭容器中充入2mol A和3mol B,发生如下化学反应:aA+B C+B(反应物、产物均为气体)平衡后测知各物质浓度有如下关系:{c (A)}a·c(B)=c(C)·c(D)然后在温度不变的情况下,扩大容器容积至原来10倍,结果A的百分含量始终未有改变,则这时B的转化率是
C+B(反应物、产物均为气体)平衡后测知各物质浓度有如下关系:{c (A)}a·c(B)=c(C)·c(D)然后在温度不变的情况下,扩大容器容积至原来10倍,结果A的百分含量始终未有改变,则这时B的转化率是
A.60%?B.40%?C.50%? D.无法确定
参考答案:B
本题解析:平衡后测知各物质浓度有如下关系:{c(A)}a·c(B)=c(C)·c(D),则根据平衡常数表达式K= 可知,K=1。在温度不变的情况下,扩大容器容积至原来10倍,结果A的百分含量始终未有改变,这说明平衡不变,因此反应前后体积不变,则a=1,所以
可知,K=1。在温度不变的情况下,扩大容器容积至原来10倍,结果A的百分含量始终未有改变,这说明平衡不变,因此反应前后体积不变,则a=1,所以
A? +? B C? +? B
C? +? B
起始量(mol) 2? 3? 0? 0
转化量(mol)x? x? x? x
平衡量(mol)2-x? 3-x? x? x
由于反应前后体积不变,所以可以用物质的量代替浓度进行平衡常数计算
则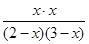 =1
=1
解得x=1.2
所以B的转化率= ×100%=40%,答案选B。
×100%=40%,答案选B。
本题难度:一般
2、选择题 在5 L的密闭容器中充入2 mol A气体和1 mol B气体,在一定条件下发生反应:2A(g)+B(g) 2C(g),达平衡时,在相同温度下测得容器内混合气体的压强是反应前的
2C(g),达平衡时,在相同温度下测得容器内混合气体的压强是反应前的 ,则A的转化率为
,则A的转化率为
A.67%
B.50%
C.25%
D.5%
参考答案:
B
本题解析:
同温度同体积时,气体的物质的量之比等于压强之比,故反应后的物质的量为
(2+1) mol× ="2.5" mol,再由差量法可知反应掉的A为1 mol,即A转化率为
="2.5" mol,再由差量法可知反应掉的A为1 mol,即A转化率为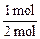 ×
×
100%=50%。
本题难度:一般
3、选择题 恒温恒压下,在一个容积可变的密闭容器中发生反应:A(g)+B(g)?C(g),若开始时通入1mol?A和1mol?B,达到平衡时生成a?mol?C.则下列说法错误的是( )
A.若开始时通入3?mol?A和3?mol?B,达到平衡时,生成的C的物质的量为3a?mol
B.若开始时通入4?mol?A、4?mol?B和2?mol?C,达到平衡时,B的物质的量一定大于4?mol
C.若开始时通入2?mol?A、2?mol?B和1?mol?C,达到平衡时,再通入3?mol?C,则再次达到平衡后,C的物质的量分数为
D.若在原平衡体系中,再通入1?mol?A和1?mol B,混合气体的平均相对分子质量不变
参考答案:A.恒温恒压下,开始时通入3?molA和3mol?B与开始时通入1molA和1molB,A与B的物质的量之比都是1:1,为等效平衡,反应物的转化率相同,故达到平衡时,生成的C的物质的量为3amol,故A正确;
B.开始时通入4?mol?A、4?mol?B和2?mol?C,可能处于平衡状态,可能向正反应进行,可能向逆反应进行,故达到平衡时,B的物质的量可能等于、小于或大于4?mol,故B错误;
C.若开始时通入2molA、2molB和1molC,达到平衡时,再通入3molC,等效为开始通入6molA、6molB,与开始时通入1molA和1molB为等效平衡,C的含量相同,由A(g)+B(g)?C(g)可知,生成amolC,混合气体总物质的量减少amol,故C的物质的量分数为a2-a,故C正确;
D.若在原平衡体系中,再通入1molA和1molB,等效为开始时通入2molA、2molB,与原平衡为等效平衡,平衡时各组分的含量不变,混合气体的平均相对分子质量不变,故D正确;
故选B.
本题解析:
本题难度:一般
4、选择题 在一密闭容器中,CO和H2O混合加热到800℃达到下列平衡:CO(g)+H2O(g)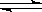 CO2(g)+H2(g) ,K=1.0,若反应开始时CO和H2O的浓度分别为0.20mol/L和1.00mol/L,则CO转化为CO2的转化率为
CO2(g)+H2(g) ,K=1.0,若反应开始时CO和H2O的浓度分别为0.20mol/L和1.00mol/L,则CO转化为CO2的转化率为
A.80%
B.83%
C.75%
D.91%
参考答案:B
本题解析:设CO转化为CO2的转化率为x,则
由反应方程式:?CO(g)+? H2O(g)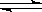 CO2(g)+H2(g) ,K=1.0
CO2(g)+H2(g) ,K=1.0
起始浓度(mol/L)0.20? 1.00? 0? 0
变化浓度(mol/L)x? x? x? x
平衡浓度(mol/L)0.20—x? 1.00—x? x? x
即:
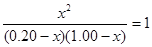 ,得
,得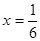 ,即得CO转化为CO2的转化率为83%
,即得CO转化为CO2的转化率为83%
本题难度:一般
5、填空题 (8分)在一定温度下,体积为2 L的密闭容器中,NO2和N2O4之间发生反应:2NO2 (g) (红棕色) N2O4(g) (无色),如图所示。
N2O4(g) (无色),如图所示。
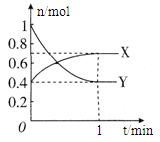
(1)曲线??(填“X”或“Y”)表示NO2的物质的量随时间的变化曲线。
(2)若升高温度,则v(正)??,v(逆)??。(填“加快”或“减慢”)。
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=18 mol/(L·min),乙中v(N2O4)=0.2 mol/(L·s),则?中反应更快。
(4)在0到1 min中内用X表示该反应的速率是?,该反应达限度时,Y的转化率?,反应开始时与反应达平衡状态时的压强之比为?。
参考答案:

本题解析:(1)由方程式N2O4(g)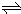 2NO2?(g),可知反应中NO2?的物质的量变化较大,则Y表示NO2的物质的量随时间的变化曲线,故答案为:Y;
2NO2?(g),可知反应中NO2?的物质的量变化较大,则Y表示NO2的物质的量随时间的变化曲线,故答案为:Y;
(2)温度升高,正逆反应速率都增大,故答案为:加快;加快;
(3)甲中v(NO2)=0.3mol?L-1?min-1,乙中v?(N2O4)=0.2mol?L-1?min-1,v(NO2)=2v(N2O4)=0.4mol?L-1?min-1,
则乙反应较快,故答案为:乙;
(4)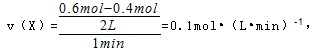
该反应达最大限度时,Y的转化率为:
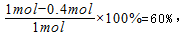
开始时:n(X)+n(Y)=0.4mol+1mol=1.4mol,
平衡时:n(X)+n(Y)=0.7mol+0.4mol=1.1mol,
在相同条件下,气体的压强之比等于物质的量之比,
则反应开始时与反应达平衡状态时的压强之比为1.4mol:1.1mol=14:11,
故答案为:0.1mol?(L?min)-1;60%;14:11;。
本题难度:一般