1、填空题 (12分)(1)对反应N2O4(g) 2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1?T2(填“>”、“<”或“=”);A、C两点的速率vA ?vC(
2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1?T2(填“>”、“<”或“=”);A、C两点的速率vA ?vC( 同上)。
同上)。

(2)在100℃时,将0.400mol的NO2气体充入2L真空定容密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
时间(s)
| 0
| 20
| 40
| 60
| 80
|
n(NO2)/mol
| 0.40
| n1
| 0.26
| n3
| n4
|
n(N2O4)/mol
| 0.00
| 0.05
| n2
| 0.08
| 0.08
|
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为?;
②该反应的平衡常数K的值为?;
③若在相同情况下最初向该容器充入的是N2O4,要达到上述同样的平衡状态,N2O4的起始浓度是?mol/L。
④计算③中条件下达到平衡后混合气体的平均相对分子质量为?;(结果保留小数点后一位)
2、选择题 下图是可逆反应A+2B 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可以推断
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可以推断

A.A、B、C、D均为气体
B.若A、B是气体,则C是液体或固体
C.逆反应是放热反应
D.正反应是放热反应
3、填空题 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空
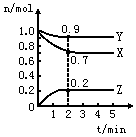
(1)该反应的化学方程式为________________。
(2)反应开始至2min,以气体Z表示的平均反应速率为________________。
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的__________倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时____________(填“增大”“减小”或“相等”)。
4、选择题 可逆反应:2NO2(g) 2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是
2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO ③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的压强不再改变的状态 ? ⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦
B.②③⑤⑦
C.①③④⑤
D.全部
5、选择题 在一个体积可变的密闭容器中,通入2molHI气体,在一定条件下建立如下平衡:2HI(g) I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是
I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是
A.保持容器体积不变,升高温度,混合气体的颜色逐渐变深
B.恒温,恒容,充入一定量氦气(不参与反应),则正反应速率和逆反应速率均增大
C.恒温,缓慢压缩容器,使容器体积恒定为0.2L,一定时间后,测得c(I2)=2.5mol/L
D.恒温、恒压,再通入2molHI气体,到达平衡状态后,HI转化率会提高