1、选择题 对于工业制硫酸中接触室内的反应:2SO2(g)+O2(g)?2SO3(g)△H<0.达到平衡时,只改变下列一个条件,平衡不发生移动的是( )
A.加入催化剂V2O5
B.恒温、恒容充入氧气
C.恒温恒容充入SO3
D.升高温度
参考答案:A.催化剂能同等程度的改变正逆反应速率,所以不影响平衡移动,故A选;
B.恒温、恒容充入氧气,氧气浓度增大,平衡向正反应方向移动,故B不选;
C.恒温、恒容充入三氧化硫,三氧化硫浓度增大,平衡向逆反应方向移动,故C不选;
D.升高温度,平衡向逆反应方向移动,故D不选;
故选A.
本题解析:
本题难度:简单
2、简答题 化学反应原理在生产、生活、国防上有重要的应用.例如:
联氨(N2H4)及其衍生物是一类重要的火箭燃料.N2H4与N2O4反应能放出大量的热.
①已知:2NO2(g)?N2O4(g)△H=-57.20kJ?mol-1.
一定温度下,在密闭容器中反应2NO2(g)?N2O4(g)达到平衡.
其他条件不变时,下列措施能提高NO2转化率的是______(填字母).
A.减小NO2的浓度B.降低温度C.增加NO2的浓度D.升高温度
②下表为反应2NO2(g)?N2O4(g)在17℃、1.01×105Pa下的部分实验数据:
| 时间/s | 0 | 80 | 160 | 240 | 320
c(NO2)/mol?L-1
0.0540
0.0420
0.0340
0.0300
0.0300
c(N2O4)/mol?L-1
0
0.0060
0.0100
0.0120
0.0120
|
该温度下反应N2O4(g)?2NO2(g)的平衡常数K的值为______.
(写出计算过程)
③25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量.
则该反应的热化学方程式为______.
参考答案:①该反应是反应前后气体体积减小的、放热的可逆反应,要使该反应向正反应方向移动,可改变反应物的浓度、体系的压强、温度等.
A、减小N02的浓度,平衡向逆反应方向移动,N02的转化率降低,故A错误;
B.降低温度,平衡向正反应方向移动,N02的转化率提高,故B正确;
C.增加N02的浓度,平衡向正反应方向移动,且体系压强增大,也利于反应向正反应方向移动,故C正确;
D.升高温度,平衡向逆反应方向移动,N02的转化率降低,故D错误;
故答案为:BC;
②图表数据分析240s反应达到平衡状态,2NO2(g)?N2O4(g),平衡状态c(NO2)=0.0300mol?L-1,c(N2O4)=0.0120mol?L-1
K=c(N2O4)c2(NO2)=0.0120mol/L(0.0300mol/L)2=403;
该温度下反应N2O4(g)?2NO2(g)的平衡常数的值为K的倒数=340,
故答案为:340;
③1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量,则2molN2H4(l)的质量为2mol×32g/mol=64g,放出热量为19.14kJ×64=1224.96KJ的热量,标注物质聚集状态和对应反应的焓变写出反应的热化学方程式为:2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l)△H=-1224.96KJ/mol,
故答案为:2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l)△H=-1224.96KJ/mol.
本题解析:
本题难度:一般
3、选择题 在相同条件下(T=500K),有相同体积的甲、乙两密闭容器.甲容器中充入1g?SO2和1g?O2;乙容器中充入2g?SO2和2g?O2.下列叙述错误的是( )
A.化学反应速率:乙>甲
B.平衡后SO3的浓度:乙>甲
C.SO2的转化率:乙>甲
D.平衡后SO2的体积分数:乙>甲
参考答案:D
本题解析:
本题难度:一般
4、选择题 对于可逆反应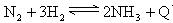 下列说法正确的是
下列说法正确的是
[? ]
A.达平衡时反应物和生成物的浓度都相等
B.达平衡后加入N2,当重新达到平衡时,NH3的平衡浓度比原平衡时增大,H2的浓度比原平衡时减少(反应前后体积不变)
C.达到平衡时,升高温度,加快了吸热反应速率,降低了放热反应速率,所以平衡向逆反应方向移动
D.达平衡后加入N2,当重新达到平衡时,N2在混合气中体积分数增大
参考答案:BD
本题解析:
本题难度:一般
5、填空题 已知氯水中有如下平衡: 常温下,在一个体积为50 mL的针筒里吸入40 mL氯气后,再吸入10 mL水。
常温下,在一个体积为50 mL的针筒里吸入40 mL氯气后,再吸入10 mL水。
(1)写出针筒中可能观察到的现象_____________。 将此针筒长时间放置,又可能观察到何种变化______________________。
(2)试用平衡观点加以解释。_______________________
参考答案:(1)气体体积缩小,溶液呈浅绿色;气体体积进一步缩小,气体和溶液均变为无色
(2)氯水中的化学平衡因HClO的逐渐分解而不断地向右移动,最终Cl2耗尽,全部转化为O2,导致气体体积缩小和黄绿色消退
本题解析:
本题难度:一般