|
高中化学知识点总结《气体的净化、干燥、吸收与收集》试题特训(2017年最新版)(二)
2018-03-17 05:32:39
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、填空题 取少量Fe2O3粉末(红褐色)加入适量盐酸,化学反应方程式为:?,得到棕黄色的FeCl3溶液,用此溶液分别做如下实验:在小烧杯中加入20 mL蒸馏水,煮沸后,滴入几滴FeCl3溶液,继续煮沸至溶液呈红褐色,即制得?,用激光笔照射烧杯中的液体,可以观察到液体中出现?,这个现象叫?。
参考答案:.(共5分)Fe2O3 + 6H+ =2Fe3++3H2O;(2分)
Fe(OH)3 胶体;光亮的通路;丁达尔现象。(每空1分)
本题解析:氧化铁是碱性氧化物,能和盐酸反应,方程式是Fe2O3 + 6H+ =2Fe3++3H2O;在小烧杯中加入20 mL蒸馏水,煮沸后,滴入几滴FeCl3溶液,继续煮沸至溶液呈红褐色,即制得氢氧化铁胶体,用激光笔照射烧杯中的液体,可以观察到液体中出现光亮的通路,这个现象叫丁达尔效应。
点评:该题是基础性试题的考查,试题难易适中,侧重对学生基础知识的巩固和训练。有助于培养学生的应试能力,提高学生分析问题、灵活运用基础知识解决实际问题的能力。该题难度不大,学生记住即可得出正确的结论。
本题难度:一般
2、实验题 实验室制取的乙烯常含有少量二氧化硫,现设计如下实验,确认混合气体中有乙烯和二氧化硫。
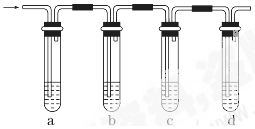
(1)a、b、c、d装置可盛放的试剂是:a________,b______,c_____,d______。
A.品红溶液
B.NaOH溶液
C.浓硫酸
D.酸性高锰酸钾溶液
| (2)确定含有乙烯的现象是_________________________________________________。
参考答案:(1)A? B? A? D
(2)c装置中品红溶液不褪色,d装置中酸性高锰酸钾溶液褪色
本题解析:二氧化硫的检验用品红溶液,乙烯的检验用高锰酸钾酸性溶液,乙烯和二氧化硫都能使高锰酸钾酸性溶液褪色,所以先检验二氧化硫,然后检验乙烯,同在检验乙烯之前用NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色检验乙烯。
(1)因装置①用来检验SO2,试管中品红溶液褪色,说明含有SO2,装置②试管装有NaOH溶液除去SO2,装置③试管通过品红溶液不褪色确认SO2已除干净,装置④通过高锰酸钾酸性溶液褪色检验乙烯,故答案为:①A;②B;③A;④D;
(2)根据以上分析,c装置中品红溶液不褪色,d装置中酸性高锰酸钾溶液褪色。
本题难度:一般
3、简答题 分冬青油是天然香料之一,其主要成分为水杨酸甲酯,可由水杨酸(邻羟基苯甲酸)和甲醇作原料在浓硫酸催化下酯化而得。
实验步骤:
Ⅰ.如图,在100 mL三口烧瓶中放入6.9 g (0.05 mol)水杨酸和24 g(30 mL,0.75 mol)甲醇,向混合物中加入约10 mL甲苯,再小心地加入8 mL浓硫酸,摇动混匀:加入1~2粒沸石,装上回流冷凝管在石棉网上保持85—95℃,加热回流1.5-2小时:
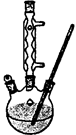
Ⅱ.待装置冷却后,分离出甲醇,向烧瓶中加入50 mL,水,然后转移至分液漏斗,分出下层产物,弃去上层水层,有机层再倒入分液漏斗中;依次用50 mL5%NaHCO3溶液洗1次(溶液呈弱碱性),30 mL水洗一次(产物皆在下层),有机层得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分。产品经0.5 g无水CaCl2干燥后称重。
常用物理常数:

请根据以上信息回答下列问题:
(1)制备冬青油的化学方程式为______________。
(2)制备冬青油时,最合适的加热方法是_______________。实验中加入甲苯作带水剂的目的是____________________。
(3)反应结束冷却后,分离甲醇的操作是:___________________;
(4)在提纯粗产品的过程中,用碳酸氢钠溶液洗涤主要除去的杂质是____________:若
改用氢氧化钠溶液是否可以____________(填“可以”或“不可以”),其原因是________________。
(5)检验产品中是否含有水杨酸的化学方法是__________________。最终称得产品的质量为4.2 g,则所得水杨酸甲酯的产率为___________(保留两位有效数字)。
参考答案:(1)
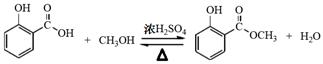 (2分); (2分);
(2)水浴加热(1分) 反应产生的水从反应体系中分离开来,使得平衡向右移动,同时可以减少甲醇的用量,从而提高反应的产率 (2分)?
(3)蒸馏(1分)
(4)水杨酸(1分) 不可以(1分)?在氢氧化钠溶液中水杨酸甲酯发生水解(1分)
(5)取少量晶体于试管中,加蒸馏水溶解,滴加NaHCO3溶液,若出现无色气泡则含水杨酸(答案合理即可)(2分)?55%(2分)
本题解析:(1)制备冬青油的化学方程式为
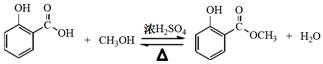 (2分) (2分)
(2)制备冬青油时,85—95℃最合适的加热方法是水浴加热;实验中加入甲苯作带水剂的目的是反应产生的水从反应体系中分离开来,使得平衡向右移动,同时可以减少甲醇的用量,从而提高反应的产率;
(3)因为甲醇的沸点低,分离甲醇的操作是蒸馏;
(4)用碳酸氢钠溶液洗涤主要除去的杂质是酸性物质水杨酸;NaOH不可以做洗涤剂,因为在氢氧化钠溶液中水杨酸甲酯发生水解;
(5)检验产品中是否含有水杨酸的化学方法是取少量晶体于试管中,加蒸馏水溶解,滴加NaHCO3溶液,若出现无色气泡则含水杨酸(答案不唯一);6.9 g (0.05 mol)水杨酸应得到0.05mol水杨酸甲酯,即7.6g,产品的质量为4.2 g,故所得水杨酸甲酯的产率为55%。
本题难度:一般
4、实验题 (8分)某中学化学研究性学习小组利用以下装置制取并探究氨气的性质。A中发生反应的化学方程式:2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑+ 2H2O CaCl2 + 2NH3↑+ 2H2O

(1)A中的反应?(填“是”或“不是”)氧化还原反应;
(2)A装置还可用于制取气体?(只填一种);
(3)实验室收集氨气的方法是?;
(4)C、D装置中颜色会发生变化的是?(填“C”或“D”);
(5)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是?(填“F”或“G”);
(6)当实验进行一段时间后,挤压E装置中的胶头滴管,滴人1-2滴浓盐酸,可观察到的现象是?;
(7)2010 年 11月9日晚,我省一冷冻厂发生氨 气泄漏事件,500 多居民深夜大转移。假如你在现场,你会采用什么自救为法??。 气泄漏事件,500 多居民深夜大转移。假如你在现场,你会采用什么自救为法??。
参考答案:( 1)不是? 1)不是?
(2)O2(或氧气,其他合理答案也给分)
(3)向下排空气法?
(4)D?
(5)F?
(6)有白烟生成?
(7)①用湿毛巾捂住口鼻,并迅速撤离。②低头弯腰,往低处跑,迅速撤离。③逆风奔跑,迅速撤离。④戴上防毒面具,迅速撤离。(以上任选其一或其他合理答案也给分)
本题解析:略
本题难度:一般
5、选择题 下列气体中,只能用排水集气法收集,不能用排空气法收集的是
A.NO
B.NH3
C.C2H4
D.CH4
参考答案:AC
本题解析:只能用排水集气法收集,不能用排空气法收集即该气体不溶于水,且能与空气反应的气体;
A正确,NO不溶于水,但能与空气中的氧气反应生成二氧化氮;B错,NH3极易溶于水,但不与空气成分反应可用向下排空气法制备;C正确,C2H4?虽不会与空气的成分反应,但它的密度仅仅略小于空气,只能用排水法收集;D错,CH4既可用排水法收集又可用排空气法收集;
本题难度:简单
|