1、选择题 下列气体实验中,正确的是?(?)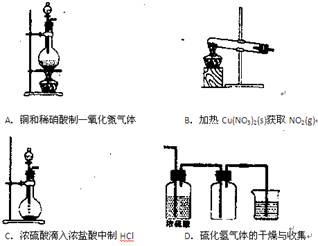
参考答案:AC
本题解析:硝酸铜受热分解产生的气体很复杂,有氧气、二氧化氮等,所以B错;硫化氢是还原性气体,不能用浓硫酸干燥,能发生氧化还原反应。所以D错。
本题难度:一般
2、选择题 已知NH3难溶于CCl4,如下图所示,下列装置中,不宜用于吸收氨气的是 (?)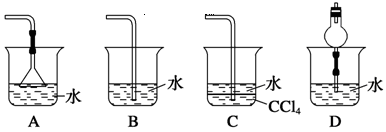
参考答案:B
本题解析:氨气极易溶于水,如果导管直接插入水中,则容易引起液体倒流,所以选项B是错误的,其余选项都能起防倒流的作用,答案选B。
本题难度:一般
3、实验题 (每空2分,共18分)现有A、B、C、D、E五种物质,并存在如下转化关系.其中E为黑色粉末,在下图转化中均作催化剂
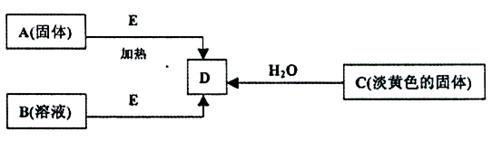
(1)B的化学式?
(2)利用下图所示的实验装置进行C与水的反应,回答下列有关同题:

①?固体C与水反应生成D的化学方程式为:?.
②?检验导管出口气体的方法为:?.
③烧杯中的现象为:?.
(3)在加热条件下,某无氧酸(含有A中的一种元素)的浓溶液与E反应,生成单质气体X.为检验X的性质,设计如下图所示实验装置:
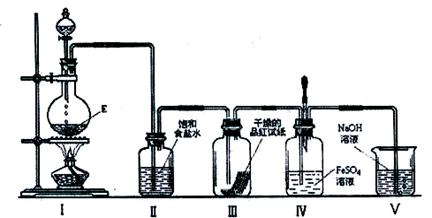
①实验过程中,观察到装置Ⅲ中的品红试纸的红色褪去,并未观察到“无明显变化”这一预期现象.为了达到这一预期现象,你认为应该如何改进?
?。
②实验结束后,装置Ⅳ中可观察到现象是 ,若滴加两滴胶头滴管中的试剂,观察到溶液呈血红色,有关的离子方程式为:
?, 。
③X是一种重要的化工原料,用化学方程式表示X在化工生产上的一项用途:
??。
参考答案:(每空2分,共18分)(1)H2O2
(2)?①2Na2O2 + 2H2O =" 4NaOH" + O2↑②用带火星的木条靠近导管出口,观察木条是否复燃。
(或“用排水集气法收集一试管气体,用带火星的木条伸入试管中,观察木条是否复燃。”)
③出现浑浊(或“产生白色沉淀”)(3) ①在装置II、Ⅲ之间加入一个盛有浓硫酸的洗气瓶;②溶液由浅绿色变为黄色2Fe2+ + Cl2 = 2Fe3+ + 2Cl-、Fe3+ + 3SCN- = Fe(SCN)3?(其他合理的写法均可)
③H2+Cl2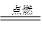 2HCl(写“光照”不得分)或2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O或CH2=CH2+Cl2
2HCl(写“光照”不得分)或2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O或CH2=CH2+Cl2 CH2Cl—CH2Cl?(其他合理答案均可)
CH2Cl—CH2Cl?(其他合理答案均可)
本题解析:C是淡黄色固体,则C是过氧化钠,所以D是氧气。因此A是氯酸钾,E是二氧化锰,B是双氧水。
(1)双氧水的化学式为H2O2。
(2)①过氧化钠和水反应的方程式为2Na2O2 + 2H2O =" 4NaOH" + O2↑。
②检验氧气可以用带火星的木条靠近导管出口,观察木条是否复燃。
③过氧化钠和水反应是放热反应,溶液中OH-浓度增大,且氢氧化钙的溶解度降低,所以会析出晶体、
(3)①C是浓盐酸和二氧化锰反应生成氯气。由于起漂白作用的是次氯酸,所以要观察到“无明显变化”这一预期现象,需要除去氯气中混有的水蒸气,因此在装置II、Ⅲ之间加入一个盛有浓硫酸的洗气瓶。
②氯气具有氧化性,能氧化硫酸亚铁,生成硫酸铁,所以溶液由浅绿色变为黄色。方程式为2Fe2+ + Cl2 = 2Fe3+ + 2Cl-。铁离子没和KSCN溶液反应,用来检验铁离子,方程式为Fe3+ + 3SCN- = Fe(SCN)3。
③氯气可以用来制取盐酸、漂白粉等。
本题难度:一般
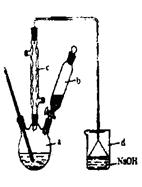
4、实验题 溴苯是一种常用的化工原料。实验室制备溴苯的实验步骤如下:
步骤1:在a中(装置如右下图所示)加入15mL无水的苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应。
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑。
步骤3:滤液依次用10mL水8mL 10%的NaOH溶液,10mL水洗涤,分液得粗溴苯。
步骤4:向分出的粗溴苯中加入少量的无水氯化钙、静置、过滤即得粗产品。
?
| 苯
| 溴
| 溴苯
|
密度/gcm-3
| 0.88
| 3.10
| 1.50
|
沸点/℃
| 80
| 59
| 156
|
水中的溶解度
| 微溶
| 微溶
| 微溶
|
(1)仪器a的名称是?。
(2)将b中的液溴慢慢加入到a中,而不能快速加入的原因是?。
(3)仪器c的作用是冷凝回流,回流的主要物质有?。(填化学式)
(4)步骤3中第一次用10mL水洗涤的主要操作步骤为?。
(5)步骤4得到的粗产品中还含有杂质苯。已知苯、溴苯的有关物理性质如左上表,则要进一步提纯粗产品,还必须进行的实验操作名称是?。
(6)若步骤4的粗产品经进一步精制得到6.5mL的溴苯。则该实验中溴苯的产率是?。
参考答案:(1)三颈烧瓶(2)防止反应放出的热使C6H6、Br2挥发而影响产率
(3)C6H6、Br2
(4)将滤液置于分液漏斗中,加入10 mL水,充分振荡后静置分液(分离出上层物质待用)
(5)蒸馏(6)80%
本题解析:(1)根据仪器的构造可知,应该是三颈烧瓶。
(2)由于反应是放热的,且苯和液溴都是易挥发的,所以目的是防止反应放出的热使C6H6、Br2挥发而影响产率。
(3)根据(2)的分析可知,回流的物质是C6H6、Br2。
(4)溴苯不溶于水,所以操作是将滤液置于分液漏斗中,加入10 mL水,充分振荡后静置分液(分离出上层物质待用)。
(5)苯、溴苯的沸点相差较大,通过蒸馏即可。
(6)苯的质量是15×0.88=13.2g,液溴是3.1×4=12.4g。所以根据方程式可知,苯是过量的,因此应该生成溴苯是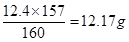 。实际生成溴苯是6.5×1.5=9.75g,所以产率是
。实际生成溴苯是6.5×1.5=9.75g,所以产率是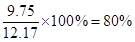
本题难度:一般
5、选择题 下列装置能达到实验目的的是
 ?
? ?
? ?
?
①?②?③?④
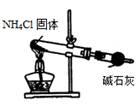
A.用①装置制取干燥的氨气
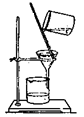
B.用②装置除去淀粉溶液中的NaCl
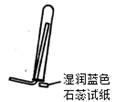
C.③装置可用于氨气的收集、检验
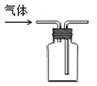
D.④装置可用排空气法收集氢气
参考答案:D
本题解析:A、①装置中的氯化铵分解后在试管口就会重新生成氯化铵,不会进到干燥管,错误;B、淀粉中的NaCl是通过渗析的方法来除,而不是过滤,错误;C、是用湿润的红色石蕊试纸,错误;D、正确。
本题难度:一般