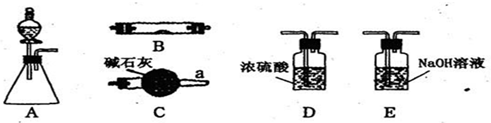
1、填空题 如图所示为常见气体制备、干燥、性质验证和尾气处理的部分仪器装置(加热设备及固定装置均略去),请根据要求完成下列各题,仪器装置可任意选用,必要时可重复选择.
(1)若锥形瓶中盛装锌片,分液漏斗中盛装稀硫酸,可验证H2的还原性并检验H2的氧化产物.当仪器连接顺序为A→D→B→B→C时,两次使用B装置,其中所盛的药品依次是CuO、______.
(2)若锥形瓶中盛装______固体,分液漏斗中盛装浓氨水,B中盛装固体催化剂,可进行氨的催化氧化,其反应产物为NO和H2O.
①各仪器装置按气流方向从左到右连接顺序A→C→B→E,请写出B中氨的催化氧化反应方程式______.
②装置C的作用是______.
(3)若锥形瓶中盛装Na2SO3固体,分液漏斗中盛装H2SO4溶液,B中盛装Na2O2固体,可探究SO2气体与过氧化钠反应时是否有O2生成.
若SO2与过氧化钠反应没有O2生成,根据气流方向,从图中世择适当的仪器进行实验,装置的连接顺序为(填字母):A→______→______→______,装置B中可能观察到的现象是______.
若有O2生成,实验室检验O2的方法是______.
参考答案:(1)第二次使用B装置的作用是检验产物水,可用无水硫酸铜,故答案为:无水硫酸铜;
(2)根据进行进行氨的催化氧化可知A为制取氧气的装置,故锥形瓶中盛装Na2O2,故答案为:Na2O2;
①氨的催化氧化反应方程式:4NH3+5O2=4NO+6H2O,故答案为:4NH3+5O2=4NO+6H2O;
②碱石灰可干燥气体,C的作用为除去水蒸气,干燥氨气和氧气,故答案为:除去水蒸气,干燥氨气和氧气;
(3)A生成的二氧化硫通过D浓硫酸可干燥二氧化硫,然后在B中与过氧化钠反应,再通过C除掉未反应的二氧化硫,若有氧气生成,则E中有气泡生成,反之则无;过氧化钠是淡黄色固体,与二氧化硫反应后生成硫酸钠白色固体,故B中现象为淡黄色固体粉末变为白色;实验室检验O2的方法是用带火星木条放到导气管出口,木头复燃证明有氧气,
故答案为:D;B;C/E;淡黄色固体粉末变为白色;用带火星木条放到导气管出口,木头复燃证明有氧气;
本题解析:
本题难度:一般
2、选择题 有NaCl、KSCN、NaOH、AgNO3四种溶液,只用一种试剂就把它们鉴别开来,这种试剂是(?)
A.盐酸
B.Na2CO3溶液
C.氯水
D.FeCl3溶液
参考答案:D?
本题解析:FeCl3溶液加入四种溶液中依次出现的现象是:无明显现象、溶液呈红色、生成红褐色沉淀、白色沉淀
本题难度:一般
3、实验题 (10分)实验室有CuO和铜粉的混合物。要测定该样品(已称得其质量为m g)中氧化铜的质量分数。用下图所示仪器装置制取H2,再用H2还原CuO,最后根据样品质量的减少和无水CaCl2质量的增加来测定样品中氧化铜的质量分数。
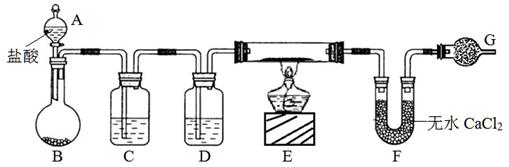
请回答:
(1)仪器中装入的试剂:D?。
(2)操作“①打开A的活塞”和“②点燃E处酒精灯”应该先进行的是?(填序号),在这两步操作之间还应进行的操作是:?。
(3)若实验中有部分CuO被还原为红色的Cu2O,对实验的影响为_____(偏大、偏小、无影响)。
(4)若测得的原质量为a g的硬质玻璃管(E),反应后质量变为b g;U型管实验后质量增加n g,由以上数据可以列出计算氧化铜质量分数的两个不同计算式:
计算式1:?;计算式2:?。
参考答案:(1)浓硫酸(1分)
(2)①(1分)收集G处的气体检验纯度(2分)
(3)偏小(2分)
(4)5(a-b)/m(2分) 40n/9m(2分)
本题解析:(1)由于生成的氢气中含有水蒸气,会干扰后面的实验,所以D中的盛放的应该是浓硫酸,用来除去水蒸气。
(2)由于装置中含有空气,所以应该首先生成氢气,将装置中的空气排尽。氢气是可燃性气体,再点燃之前,需要收集G处的气体检验纯度。
(3)若实验中有部分CuO被还原为红色的Cu2O,则生成的水就减少,因此氧化铜的质量分数就减少。
(4)根据方程式H2+CuO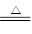 Cu+H2O可知,固体减少的质量就是氧化铜中氧原子的质量,所以氧化铜的质量是
Cu+H2O可知,固体减少的质量就是氧化铜中氧原子的质量,所以氧化铜的质量是 ,所以氧化铜的质量分数是5(a-b)/m;生成水的质量是ng,则氧化铜的质量是
,所以氧化铜的质量分数是5(a-b)/m;生成水的质量是ng,则氧化铜的质量是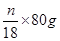 ,所以氧化铜的质量分数是40n/9m。
,所以氧化铜的质量分数是40n/9m。
本题难度:一般
4、选择题 下列有关实验原理或操作正确的是( )
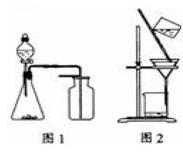
A.选择合适试剂,用图1所示装置可分别制取收集少量NO2、O2、NH3
B.稀释浓硫酸时,应将浓硫酸沿玻璃棒缓慢注入蒸馏水中并搅拌
C.洗涤沉淀操作如图2,向漏斗中加适量蒸馏水,用玻璃棒搅拌滤干,重复操作2~3次
D.用蒸馏水润湿的广泛pH试纸测0.10 mol·L-1NH4Cl溶液
参考答案:B
本题解析:略
本题难度:一般
5、填空题 工业上生产高氯酸(沸点:90oC)时还同时生产了亚氯酸钠,其工艺流程如下:

(1)冷却过滤的目的??。
(2)通入反应器2的SO2作用是?;反应器2中发生反应的离子方程式为?。
(3)循环使用的物质是??。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是?。
(5)通过电解NaClO3水溶液的方法也可以制备NaClO4,进而可以制备HClO4,写出阳极的电极反应式??。
参考答案:(1)降低NaHSO4的溶解度并分离出NaHSO4晶体(2分)
(2)二氧化硫作为还原剂把ClO2还原为NaClO2、(2分)
2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O;(4分)
(3)H2SO4(2分)
(4)高氯酸的沸点比较低,容易从溶液中逸出;(2分)
(5)阳极反应式? H2O+ClO3—-2e—= ClO4— + 2H+。(4分)
本题解析:略
本题难度:一般