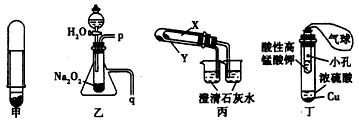
1、选择题 下列应用套管实验装置(部分装置未画出) 进行的实验,叙述错误的是
?
[? ]
A.利用甲装置可以制取少量H2
B.利用乙装置可以验证Na2O2与水反应既生成氧气,又放出热量
C.利用丙装置验证KHCO3和K2CO3的热稳定性,X中应放的物质是K2CO3
D.利用丁装置制取SO2,并检验其还原性,小试管中的试剂可为酸性KMnO4溶液
参考答案:C
本题解析:
本题难度:一般
2、实验题 (16分)小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3·10H2O),为测定试样中小苏打的质量分数ω(NaHCO3),实验小组同学设计了如下装置进行实验。

[实验过程]
①按图组装仪器,检查装置的气密性;
②将m1g试样放入硬质玻璃管中,装置B、C、D 中药品如图,己知加药品后装置B的质量为m2 g装置C 的质量为m3g;
③关闭活塞a,点燃酒精灯加热试样,直到B 装置中无气泡冒出后,打开活塞a 向装置中通人N2,一段时间后,撤掉酒精灯,关闭活塞a;
④称得装置B 的质量为m4g、装置C 的质量为m5g。
请回答以下问题(装置中原有空气对实验的影响忽略不计):
⑴装置A中发生反应的化学方程式为____________________________________
⑵装置B的作用为__________________________________________
装置C的作用为________________________________________________
⑶实验过程中通入N2的目的为__________________________________________
⑷用下列各项所提供的数据能计算出ω(NaHCO3)的是____________(填选项字母)。
序号
| a
| b
| c
| d
| e
|
数据
| m1、m2、m3
| ? m2、m3、
m4、m5
| m1、m2、m4
| m1、m4、m5
| m1、m3、m5
|
⑸实验结束后发现装置A 中硬质玻璃管右端有水珠,你认为利用实验中所提供的数据还能否得到准确的ω(NaHCO3),若能,则ω(NaHCO3)的计算式为:__________________;若不能,此问不作答。
参考答案:⑴2NaHCO3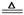 Na2CO3 + CO2 + H2O (2分)、Na2CO3·10H2O
Na2CO3 + CO2 + H2O (2分)、Na2CO3·10H2O  Na2CO3 + 10 H2O (2分)
Na2CO3 + 10 H2O (2分)
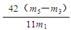
⑵吸收反应生成的水蒸气(2分) ;吸收反应生成的CO2 (2分);
⑶把装置中的CO2和水蒸气排出被装置B和装置C吸收(2分)
⑷b、c 、e? (3分)?;
(5)×100% (3分)
本题解析:(1)装置A中,样品中的NaHCO3受热分解产生CO2、H2O、Na2CO3;Na2CO3·10H2O受热失去结晶水,据此可写出反应方程式。
(2)装置B中的浓硫酸能吸收样品分解产生的水蒸气,装置C中的碱石灰能吸收样品分解产生的CO2。
(3)由于受热分解后,装置中含有CO2、水蒸气,通入N2能将装置中的CO2、H2O排出而被装置C、B吸收,从而降低实验误差。
(4)根据实验原理,样品分解产生的CO2只能被装置c吸收,根据(m5-m3)的质量这个得出分解的NaHCO3的质量,也可得出分解产生的H2O的质量,再根据(m4-m2)的质量并结合NaHCO3分解产生H2O的质量,则可得出Na2CO3·10H2O的质量,为此可得出样品总质量和NaHCO3的质量,从而计算出NaHCO3的质量分数,所以b组数据能计算出NaHCO3质量分数;由m1样品质量和(m2-m4)的质量可得出NaHCO3的质量,从而可计算出NaHCO3的质量分数,故c组数据能计算出NaHCO3质量分数;有m1的样品质量和(m5-m3)的质量可得出NaHCO3的质量,从而可计算出NaHCO3的质量分数,故e组数据能计算出NaHCO3质量分数,但a、d组数据不能计算出NaHCO3质量分数。
(5)选择e组数据计算则与A装置中的水珠无关,根据反应2NaHCO3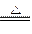 Na2CO3+CO2↑+ H2O,生成CO2的质量=(m5-m3)g,则m1g 样品中NaHCO3的质量=
Na2CO3+CO2↑+ H2O,生成CO2的质量=(m5-m3)g,则m1g 样品中NaHCO3的质量= ,故
,故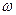 (NaHCO3)=
(NaHCO3)=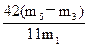 ×100%。
×100%。
本题难度:一般
3、选择题 下列实验中,不能观察到明显变化的是
A.把绿豆大的钾投入少量水中
B.把一段打磨过的镁带放入少量冷水中
C.把溴水加入到淀粉K I溶液中
D.氢气和氯气等体积混合后强光照射
参考答案:B
本题解析:略
本题难度:简单
4、实验题 某学校化学兴趣小组想利用元素周期表中第三周期的某些元素探究元素的金属性和非金属性随原子序数变化的规律。该兴趣小组选择的实验仪器和试剂:烧杯、试管、酒精灯、蒸馏水、稀盐酸、酚酞溶液等。
(1)根据上述实验仪器和试剂,该兴趣小组要进行实验探究的元素是____________。
(2)在探究上述元素的单质与水反应时,为了保证实验的安全性,应该在________(填“试管”或“烧杯”)中进行反应,为了切实保证不出危险,还需进行的操作有________________。
(3)在水中滴入1 mL酚酞试剂,但实验时(包括实验后),发现只有钠与水反应的溶液显红色,于是有位 同学得出结论:钠、镁、铝中只有钠能与水反应。你觉得这个结论_________(填“正确”或“不正确”),如果不正确,请你还利用水这种“试剂”来设计实验探究镁与铝的金属性强弱。你的实验设计是__________________。并预测实验现象________________________。
(4)小组中的另外一位同学设计实验用酸来探究这些金属的金属性,但老师删掉了该同学设计的酸与钠反 应的实验,你觉得老师这样做的目的是__________________。该同学在两支试管中各加入2 mL 稀盐酸,然后在其中一支试管中加入2片镁片,另外一支试管中加入2片铝片,反应开始的时候现象是__________________。不过该同学操作时在第二支试管中加入了两块质量较大的铝条,他观察到随着反应的进行,铝与酸的反应越来越快,直至最后反应几乎呈沸腾状态,请你推测铝与盐酸产生这种现象的原因是_________________________。
(5)最后该小组得出实验结论:______________________。
参考答案:(1)钠、镁、铝
(2)烧杯;在烧杯上放一块玻璃片
(3)不正确;在两支试管中分别加入2 mL蒸馏水,再在其中分别滴入2~3滴酚酞试剂,然后在一支试管中加入2片镁片,另外一支试管中加入2片铝片,最后用酒精灯加热,观察试管内溶液颜色的变化;镁片在热水中有气泡产生,水溶液变为浅红色
(4)因为钠与酸反应非常剧烈,防止发生爆炸事故;镁与盐酸反应剧烈,而铝与盐酸能够反应;该反应是放热反应,随着反应的进行,反应液的温度升高,反应速率变快
(5)随着原子序数的递增,钠、镁、铝的金属性逐渐减弱,故同周期元素随着元素序数的递增,元素的金属性逐渐减弱(或非金属性逐渐增强)
本题解析:
本题难度:一般
5、实验题 如下图所示,将浸透了石蜡油的(17个碳原子以上的液态烷烃混合物)的石棉放置在硬质试管的底部,试管中加入碎瓷片,给碎瓷片加强热,石蜡油蒸汽通过炽热的碎瓷片表面发生反应,生成一定量的气体。利用该气体进行实验:
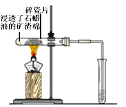
(1)如果将气体通入溴的四氯化碳溶液中,观察到的现象是_______________________________。
(2)如果将气体通入酸性KMnO4溶液中,现象是_____________________________。
(3)通过以上实验,结合所学知识,你认为生成的气体是____________(填序号)。
A.只有烷烃 B.烷烃与烯烃的混合物 C.只有烯烃 D.全为烯烃但不是纯净物
参考答案:(1)溴的四氯化碳溶液褪色
(2)酸性高锰酸钾溶液褪色(或红色褪去)
(3)B
本题解析:
本题难度:一般