|
高考化学必考知识点《铁的氧化物》高频考点特训(2017年练习版)(二)
2018-03-17 05:41:31
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、填空题 以黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)为原料炼铜的方法分为高温炼铜和湿法炼铜两种。近年来,湿法炼铜有了新进展,科学家发现有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿氧化成硫酸盐:4CuFeS2+2H2SO4+17O2 4CuSO4+2Fe2(SO4)3+2H2O。某工厂运用该原理生产铜和绿矾的工艺如下: 4CuSO4+2Fe2(SO4)3+2H2O。某工厂运用该原理生产铜和绿矾的工艺如下:

回答下列问题:
(1)下列物质中可以用于上述流程中调节溶液pH的是 (填序号)。
A.Cu;
B.Cu2(OH)2CO3;
C.H2SO4;
D.Fe;E.CuO
| (2)滤渣A的主要成分为 ?(写化学式)。
(3)写出反应Ⅰ的化学方程式: ?。
(4)试剂a为 ? 。
(5)欲从溶液中获得绿矾晶体,分离操作Ⅰ应为 (写操作名称)。
(6)生产过程中,除了试剂a、H2O可以循环使用外,还可循环使用的物质有 (写化学式)。
参考答案:(1)BE
(2)Fe(OH)3
(3)2CuSO4+2H2O 2Cu+2H2SO4+O2↑ 2Cu+2H2SO4+O2↑
(4)铁粉
(5)蒸发浓缩、冷却结晶、过滤
(6)H2SO4、O2
本题解析:(1)流程图中的混合溶液为CuSO4和Fe2(SO4)3。调节pH的目的是除去Fe3+,Fe3+水解的方程式为:Fe3++3H2O Fe(OH)3+3H+。要求加入的试剂能与H+反应,不能引入除Cu2+、Fe3+外的其他杂质离子,不能与Fe3+反应,故供选试剂中只有B、E适合。(3)电解CuSO4溶液,其产物为Cu、O2和H2SO4。(4)Fe(OH)3与H2SO4反应生成Fe3+,最终要得到绿矾,故试剂a应为铁粉。(5)绿矾含有结晶水,从溶液中分离的操作步骤为蒸发浓缩、冷却结晶,最后过滤即可。(6)电解生成的H2SO4和O2也可循环 Fe(OH)3+3H+。要求加入的试剂能与H+反应,不能引入除Cu2+、Fe3+外的其他杂质离子,不能与Fe3+反应,故供选试剂中只有B、E适合。(3)电解CuSO4溶液,其产物为Cu、O2和H2SO4。(4)Fe(OH)3与H2SO4反应生成Fe3+,最终要得到绿矾,故试剂a应为铁粉。(5)绿矾含有结晶水,从溶液中分离的操作步骤为蒸发浓缩、冷却结晶,最后过滤即可。(6)电解生成的H2SO4和O2也可循环
使用。
本题难度:困难
2、填空题 某废金属屑中主要成分为Cu、Fe、Al,还含有少量的铜锈[Cu2(OH)2CO3]、少量的铁锈和少量的氧化铝,用上述废金属屑制取胆矾(CuSO4·5H2O)、无水AlCl3和铁红的过程如下图所示:
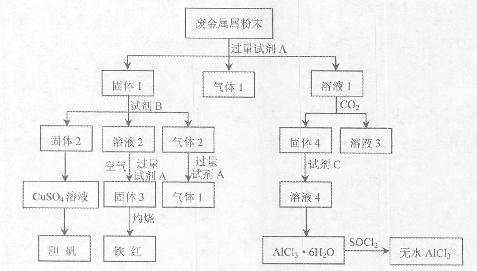
已知:?①Al3+、Al(OH)3、AlO2-有如下转化关系:
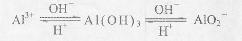
②碳酸不能溶解Al(OH)3。
请回答:
(1)在废金属屑粉末中加入试剂A,生成气体1的反应的离子方程式是?。
(2)溶液2中含有的金属阳离子是?;气体2的成分是?。
(3)溶液2转化为固体3的反应的离子方程式是?。
(4)固体2制取CuSO4溶液有多种方法。
①在固体2中加入浓H2SO4,并加热,使固体2全部溶解得CuSO4溶液,反应的化学方程式是?。?
②在固体2中加入稀H2SO4后,通入O2并加热,使固体2全部溶解得CuSO4溶液,反应的离子方程式是?。
(5)溶液1转化为溶液4过程中,不在溶液1中直接加入试剂C,理由是?。
(6)直接加热AlCl3·6H2O不能得到无水AlCl3。SOCl2为无色液体,极易与水反应生成HCl和一种具有漂白性的气体。AlCl3·6H2O与SOCl2混合加热制取无水AlCl3,反应的化学方程式是?。
参考答案:
本题解析:略
本题难度:一般
3、选择题 要除去氯化铁中少量的氯化亚铁,可行的是
A.通入氯气
B.滴入KSCN 溶液
C.加入铜粉
D.加入铁粉
参考答案:A
本题解析:考查铁的化合物的性质
除杂的过程中不能引入新的杂质,故可向溶液中通入氯气:氯化亚铁将被氧化为氯化铁,答案为A,而其它三选项中的物质均可与氯化铁反应,排除
本题难度:一般
4、选择题 使O.1 mol Fe203在CO中还原,并将生成气体通入足量的澄清石灰水中,反应一段时间后停止,得到白色沉淀0.24 mol,则被还原的Fe203的物质的量为
A.O.08 mol
B.0.1 mol
C.O.24 mol
D.O.12 mol
参考答案:A
本题解析:生成的CaCO3为0.24mol,故CO为0.24mol,Fe203+3CO=2Fe+3CO2,故被还原的Fe203的物质的量为0.08mol
本题难度:一般
5、填空题 (4分)把足量的铁粉投入到100 mL 1.0 mol/L的盐酸中,充分反应后能得到标准状况下氢气的体积是多少?(要求有计算过程)
参考答案:
解:设反应后得到标况下H2的体积为xL
Fe? +? 2HCl? =? FeCl2?+? H2
2? 22.4
100×10-3×1.0 mol?X L
X="1.12" L
答:得到标准状况下氢气的体积1.12 L。
本题解析:本题考察的是化学反应计算,在本题中,铁粉是足量的,因此在计算时不能以铁粉为切入点,而应该以盐酸为切入点来进行计算即可。
点评:本题属于简单计算,抓住利用方程式计算,物质的量之比等于方程式计量数之比,注意有时还需换算单位。
本题难度:一般
|