1、选择题 下列说法错误的是
A.仅用KSCN可以检验Fe2+
B.可以用NaOH溶液检验Fe3+
C.通过化合反应可以得到Fe(OH)3
D.通过化合反应可以得到FeCl2
参考答案:A
本题解析:A、KSCN溶液与氯化亚铁混合没有实验现象,要检验亚铁离子,还需要氧化剂例如氯气等,A不正确;B、氢氧化钠溶液与铁离子反应生成红褐色沉淀氢氧化铁,可以检验铁离子,B正确;C、氢氧化亚铁与氧气、水发生化合反应生成氢氧化铁,C正确;D、氯化铁与铁发生化合反应生成氯化亚铁,D正确,答案选A。
本题难度:简单
2、填空题 下列物质之间有如下反应关系:

已知由E转化成C的现象是:白色沉淀迅速变为灰绿色,最后变为红褐色。回答:
(1)写出下列物质的化学式:甲________,丙________。
(2)写出E→C反应的化学方程式:___________________________。为了获得E,可以用新配制的D溶液与用不含O2的蒸馏水配制的乙溶液反应制备。
(3)用相应晶体配制上述D溶液时你觉得还需加入?。
(4)写出Fe与H20在一定条件下反应的化学方程式? 。
参考答案:(1) Cl2 KSCN?(2)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)铁粉?(4)3Fe + 4H20(g) Fe3O4+4H2
Fe3O4+4H2
本题解析:(1)A为红棕色粉末,则A为Fe2O3,A与盐酸反应生成B,B为FeCl3,D为FeCl2,乙为NaOH,则E为Fe(OH)2,C为Fe(OH)3,由D→B的转化可知,甲为氯气或氯水等,由血红色溶液可知,丙为KSCN;(2)E→C反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;(3)用相应晶体配制FeCl2溶液时需加入铁粉;(4)Fe与H20在一定条件下反应的化学方程式为:3Fe+4H20(g) Fe3O4 +4H2 ?。
Fe3O4 +4H2 ?。
本题难度:一般
3、实验题 某同学欲在实验室中完成Fe与水蒸气反应的实验,装置如图甲、乙两种。
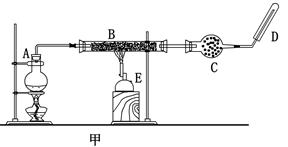
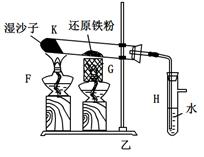
已知:B中放入的是铁与石棉绒的混合物,C中放的是干燥剂,E为酒精喷灯,G为带有铁丝网罩的酒
精灯。对比两装置,回答下列问题:
(1)如何检查乙装置的气密性:??。
(2)乙装置中湿沙子的作用是:??。
(3)B处发生反应的化学方程式:??。
(4)称取mg铁粉与适量石棉绒混合,然后加热至无气体放出。若收集的气体体积换算为标准状况为VL,铁粉的转化率为?(列出计算式即可,不必化简)。
(5)为了证明反应后的固体混合物中含有+3价的Fe,该同学取出少量混合物于试管中,加入一定量的盐酸使固体混合物溶解,过滤,立即向滤液中滴加KSCN溶液,结果观察到溶液的颜色没变化。经过思考,该同学认为此现象不能说明反应后的固体混合物中不含有+3价Fe。他的理由是:? _。
参考答案:(1)向H中加入水没过导管口,连接好装置,微热K,若H中导管口出现气泡,停止加热后导管中出现水柱,证明气密性良好(2分,其他合理答案也给分)
(2)提供水蒸气(1分)?(3)3Fe+4H2O Fe3O4+4H2
Fe3O4+4H2
(4)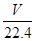 ×
×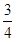 ×56×
×56×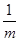 ×100%(1分)(注:化简后且正确的代数式均可,如
×100%(1分)(注:化简后且正确的代数式均可,如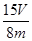 ×100%?或
×100%?或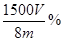 )
)
(5)铁粉可能有剩余,剩余铁粉会与Fe3+反应,将Fe3+溶液中完全还原为Fe2+。(1分)
本题解析:(1)装置气密性的检验一般采用“注水发”,因此根据乙装置的特点可知,检验乙装置的实验操作是向H中加入水没过导管口,连接好装置,微热K,若H中导管口出现气泡,停止加热后导管中出现水柱,证明气密性良好。
(2)铁再高温下与水蒸气反应小于提供反应物水蒸气,所以湿沙子的作用是提供水蒸气。
(3)高温下铁与水蒸气反应生成四氧化三铁和氢气,因此B处发生反应的化学方程式为3Fe+4H2O Fe3O4+4H2。
Fe3O4+4H2。
(4)标准状况下氢气的体积是VL,则氢气的物质的量是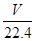 mol,所以根据反应式3Fe+4H2O
mol,所以根据反应式3Fe+4H2O Fe3O4+4H2可知,参加反应的铁的物质的量是
Fe3O4+4H2可知,参加反应的铁的物质的量是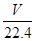 ×
×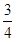 mol,其质量是
mol,其质量是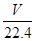 ×
×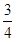 mol×56g/mol,所以铁粉的转化率为
mol×56g/mol,所以铁粉的转化率为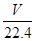 ×
×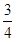 ×56×
×56×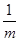 ×100%。
×100%。
(5)因为再反应中铁粉可能有剩余,剩余铁粉会与Fe3+反应,将溶液中Fe3+完全还原为Fe2+,所以向滤液中滴加KSCN溶液,未观察到溶液的颜色没变化。
本题难度:一般
4、选择题 类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是
?
| 已知
| 类推
|
A
| 将Fe加 入到CuSO4溶液中 入到CuSO4溶液中
Fe + Cu2+ =" Cu" + Fe2+
| 将Na加入到CuSO4溶液中
2Na + Cu2+ =" Cu" + 2Na+
|
B
| 氢氧燃料电池的负极反应(稀硫酸作电解质溶液):H2 – 2e— = 2H+
| 氢氧燃料电池的负极反应(氢氧化钾溶液作电解质溶液):H2 – 2e— + 2OH—=2H2O
|
C
| 用惰性电极电解CuSO4溶液
2Cu2++ 2H2O 4H+ + O2↑+ 2Cu 4H+ + O2↑+ 2Cu
| 用惰性电极电解CuCl2溶液
2Cu2+ + 2H2O 4H+ + O2↑+ 2Cu 4H+ + O2↑+ 2Cu
|
D
| 将少量CaCO3粉末投入足量盐酸中
CaCO3+ 2H+ = Ca2+ + H2O + CO2↑
| 将少量CaCO3粉末投入足量醋酸溶液中
CaCO3 + 2H+ = Ca2+ + H2O + CO2↑
参考答案:B
本题解析:略
本题难度:一般
5、填空题 (14分)铜是第四周期重要的过渡元素之一,其单质及化合物具有广泛用途。
请回答下列有关问题:
⑴铜原子的基态电子排布式是? ▲?。比较第一电离能Cu? ▲?Zn(填 “>”、“=”、“<”),说明理由? ▲?。
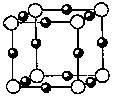
⑵氮和铜形成某种化合物的晶胞结构如图所示,则其化学式为? ▲?。(每个球均表示1个原子)
⑶铜可以形成多种多样的配合物。
① NH3可以和很多过渡金属形成配合物。NH3分子中心原子的杂化类型为? ▲ 杂化,与NH3互为等电子体的粒子有? ▲?。(只写其中一种)
②向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。试用离子方程式表示其原因 ▲ 、 ▲? 。
⑷在绿色植物标本的制作过程中,将植物材料洗净后浸入5%的硫酸铜溶液中,叶绿素(如图1)中心离子Mg2+被置换成Cu2+(如图2),叶片则永保绿色,请在图2中用箭头表示出配位键。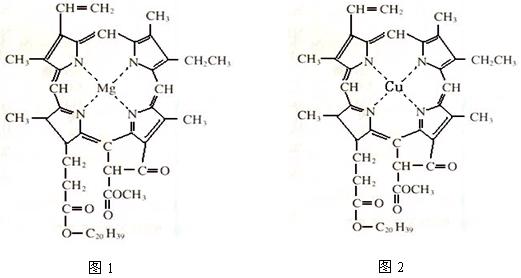
参考答案:(14分)
(1)① 1s22s22p63s23p63d104s1或[Ar] 3d104s1(2分)? <(1分) Cu失去1个电子后内层电子达到全充满的稳定状态(1分)
(2) Cu3N(2分)
(3)① SP3 ?H3O+ (各1分)
②Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+(2分)
Cu(OH)2+4NH3=Cu(NH3)42++2OH-(2分)
(3)(2分)
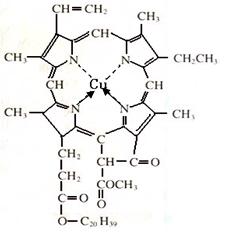
本题解析:略
本题难度:简单
|