|
高考化学知识点归纳《弱电解质电离平衡》考点预测(2017年强化版)(四)
2018-03-17 05:46:30
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、填空题 I、今有①CH3COOH、②HCl、③H2SO4三种溶液,选择序号填空:
A.①>②>③ B.①<②<③ C.①=②=③ D.①=③>②
E.①>②=③ F.①<②=③ G.①=②<③ H.①=②>③
(1)当它们的物质的量浓度相同时,其pH的关系是__________。
(2)中和等体积、等物质的量浓度的烧碱溶液,需同物质的量浓度的三种酸溶液的体积关系为______。
(3)当它们pH相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为__________。
II、在相同温度下,物质的量浓度相同的下列溶液:
a、HNO3 b、CH3COOH c、NH4NO3 d、NaOH
(4)溶液的pH由小到大的顺序是__________ ﹝填序号﹞。
(5)水的电离程度由大到小的关系是__________﹝填序号﹞。
参考答案: (1)A
(2)H
(3)E
(4)a<b<c<d
(5)c>b>a=d
本题解析:
本题难度:一般
2、选择题 pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其溶液的pH与体积(v)的关系如图所示,则下列说法正确的是( )
A.A、B两种酸溶液物质的量浓度一定相等
B.稀释后A酸溶液的酸性比B酸溶液强
C.若a=5,则A是强酸,B是弱酸
D.若A.B都是弱酸,则2<a<5
| 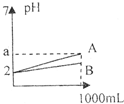
参考答案:D
本题解析:
本题难度:简单
3、选择题 在常温下,已知两种一元弱酸的酸性:HX>HY,下列说法不正确的是( )
A.在等体积和等浓度的HX与NaY相混合的溶液中:c(HY)+c(H+)=C(X-)+c(OH-)
B.同浓度的NaX和NaY两种溶液中:[c(X-)+c(OH-)]NaX溶液=[c(Y-)+c(OH-)]NaY溶液
C.在常温下,当NaX溶液的pH=8时:c(Na+)-c(X-)=9.9×10-7mol/L
D.在相同浓度的HX与HY溶液中:c(HY)>c(HX)>c(H+)>c(X-)>c(Y-)>c(OH-)
参考答案:B
本题解析:
本题难度:一般
4、填空题 (8分)已知在25 ℃时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数分别为
醋酸 K=1.75×10-5 次氯酸 K=2.95×10-8
碳酸K1=4.30×10-7 K2=5.61×10-11 亚硫酸 K1=1.54×10-2 K2=1.02×10-7
(1)写出碳酸的第一级电离平衡常数表达式K1=__________。
(2)在相同条件下,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中碱性最强的是________。等浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度大小顺序为 。
(3)若保持温度不变,在醋酸溶液中通入少量HCl,下列量会变小的是________。
a.c(CH3COO-) b.c(H+) c.醋酸的电离平衡常数
(4)下列离子方程式中错误的是________。
a.少量CO2通入次氯酸钠溶液中:CO2+H2O+ClO-===HCO3—+HClO
b.少量SO2通入次氯酸钙溶液中:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
c.过量CO2通入澄清石灰水中:CO2+OH-=== HCO3—
参考答案:
(1)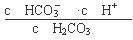 (2)Na2CO3;c(Na+)>c(HCO3—)>c(CO32—)>c(OH-)>c(H+) (2)Na2CO3;c(Na+)>c(HCO3—)>c(CO32—)>c(OH-)>c(H+)
(3)a (4)b
本题解析:(1)根据电离平衡常数的含义可得碳酸的第一级电离平衡常数表达式K1=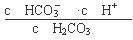 ;(2)酸的电离平衡常数越小,则相应的酸根离子结合H+的能力就越强,由于在相同温度下电离平衡常数最小的碳酸的二级电离K2=5.61×10-11,所以在相同条件下,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中碱性最强的是Na2CO3;等浓度的Na2CO3和NaHCO3的混合溶液,由于HCO3—、CO32—都会发生水解反应,而且水解程度HCO3—< CO32—,水解是溶液显碱性,c(OH-)>c(H+);但是盐水解的程度是微弱的,主要还是以盐电离产生的离子存在,所以根据物料守恒可得c(Na+)>c(HCO3—)>c(CO32—)。故溶液中各离子浓度大小顺序为c(Na+)>c(HCO3—)>c(CO32—)>c(OH-)>c(H+);(3)若保持温度不变,在醋酸溶液中通入少量HCl,a.CH3COO-会结合形成CH3COOH,所以c(CH3COO-)变小,正确;b.由于加入了H+,所以c(H+)会增大;错误;c.醋酸的电离平衡常数只与温度有关,温度不变,所以电离平衡常数就不变,错误;(4)由于酸性H2CO3>HClO> HCO3—,所以少量CO2通入次氯酸钠溶液中,会发生反应:CO2+H2O+ClO-=== HCO3—+HClO,正确;b.由于HClO有强氧化性,而H2SO3有还原性,所以少量SO2通入次氯酸钙溶液中,会发生氧化还原反应:Ca2++ClO-+SO2+H2O===CaSO4↓+2H++Cl-,错误;c.过量CO2通入澄清石灰水中,发生反应得到可溶性酸式盐,离子方程式是:CO2+OH-=== HCO3—,正确。 ;(2)酸的电离平衡常数越小,则相应的酸根离子结合H+的能力就越强,由于在相同温度下电离平衡常数最小的碳酸的二级电离K2=5.61×10-11,所以在相同条件下,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中碱性最强的是Na2CO3;等浓度的Na2CO3和NaHCO3的混合溶液,由于HCO3—、CO32—都会发生水解反应,而且水解程度HCO3—< CO32—,水解是溶液显碱性,c(OH-)>c(H+);但是盐水解的程度是微弱的,主要还是以盐电离产生的离子存在,所以根据物料守恒可得c(Na+)>c(HCO3—)>c(CO32—)。故溶液中各离子浓度大小顺序为c(Na+)>c(HCO3—)>c(CO32—)>c(OH-)>c(H+);(3)若保持温度不变,在醋酸溶液中通入少量HCl,a.CH3COO-会结合形成CH3COOH,所以c(CH3COO-)变小,正确;b.由于加入了H+,所以c(H+)会增大;错误;c.醋酸的电离平衡常数只与温度有关,温度不变,所以电离平衡常数就不变,错误;(4)由于酸性H2CO3>HClO> HCO3—,所以少量CO2通入次氯酸钠溶液中,会发生反应:CO2+H2O+ClO-=== HCO3—+HClO,正确;b.由于HClO有强氧化性,而H2SO3有还原性,所以少量SO2通入次氯酸钙溶液中,会发生氧化还原反应:Ca2++ClO-+SO2+H2O===CaSO4↓+2H++Cl-,错误;c.过量CO2通入澄清石灰水中,发生反应得到可溶性酸式盐,离子方程式是:CO2+OH-=== HCO3—,正确。
考点:考查弱电解质的电离平衡常数的应用、盐的水解、离子浓度大小比较、离子方程式的正误判断的知识。
本题难度:一般
5、填空题 (14分)现有常温下的六份溶液:
①0.01 mol/L CH3COOH溶液;
②0.01 mol/L HCl溶液;
③pH=12的氨水;
④pH=12的NaOH溶液;
⑤0.01 mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;
⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是_____(填序号,下同),水的电离程度相同的是______。
(2)将六份溶液同等稀释10倍后,溶液的pH:
①________②,③________④,⑤________⑥(填“>”、“<”或“=”)。
(3)0.020 mol/L的HCN(aq)与0.020 mol/L NaCN(aq)等体积混合,已知该混合溶液中c (Na+) > c( CN-),用“>、<、=”符号填空
①溶液中c (OH-) c (H+)
②c (HCN) c (CN-)
(4)在25mL 0.1 mol·L-1的NaOH溶液中逐滴加入0.2 mol·L-1的CH3COOH溶液,溶液pH变化曲线如图所示。
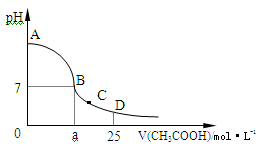
①B点溶液呈中性,有人据此认为,在B点时NaOH溶液与CH3COOH溶液恰好完全反应,这种看法是否正确?
(填“是”或“否”),如果不正确,则二者恰好完全反应的点是在 (填“AB”、“BC”或“CD”)区间内。
②在C点,溶液中离子浓度由大到小的顺序为: 。
参考答案:(1)⑥,②③④ ;(2)> > > ;(3)>, >;(4)①否 AB ;②c(CH3COO-)> c(Na+)> c(H+)> c(OH-)。
本题解析:(1)①②③④是酸或碱对水的电离起抑制作用,⑤NH3·H2O是弱碱,CH3COOH是弱酸,反应后溶液中溶质:CH3COONH4、NH3·H2O,对水的电离抑制,⑥两者恰好完全反应,生成NaCl,对水的电离无影响,所以⑥的水的电离最大,②③④溶液中c(H+)或c(OH-)相等,对水的电离影响相同;(2)①CH3COOH是弱酸,②HCl是强酸,稀释相同倍数,醋酸中的c(H+)小于盐酸中c(H+),pH:①>②;pH=12时,NH3·H2O是弱碱在稀释过程还要电离出一部分OH-,c(OH-)大于氢氧化钠溶液中c(OH-),③>④;⑤反应后溶液显碱性,⑥反应后溶液显中性,⑤>⑥;(3)混合溶液中c(Na+)>c(CN-),说明CN-的水解大HCN的电离,溶液显碱性,①c(OH-)>c(H+),②c(HCN)>c(CN-);(4)①醋酸是弱酸,氢氧化钠是强碱,两者恰好完全反应生成的CH3COONa是强碱弱酸盐,水溶液显碱性,因此这种看法不正确,填写:否,二者恰好完全反应的点在AB区间内;②在C点溶液显酸性,此时的溶质是:CH3COOH、CH3COONa,CH3COOH的电离大于CH3COO-的水解,因此离子浓度由大到小的顺序:c(CH3COO-)> c(Na+)> c(H+)> c(OH-)。
考点:考查弱电解质的电离、离子浓度大小等知识。
本题难度:困难
| 