1、选择题 下列说法中错误的是
[? ]
A.同浓度的强酸溶液的导电性一定比弱酸的强
B.强酸和强碱一定是强电解质,不管其水溶液浓度的大小,能完全电离
C.强极性共价化合物不一定都是强电解质
D.多元酸、多元碱的导电性一定比一元酸、一元碱的导电能力强
2、填空题 (Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
实验
编号
| HA的物质的量浓度(mol·L-1)
| NaOH的物质的量浓度(mol·L-1)
| 混合后溶液的pH
|
甲
| 0.1
| 0.1
| pH=a
|
乙
| 0.12
| 0.1
| pH=7
|
丙
| 0.2
| 0.1
| pH>7
|
丁
| 0.1
| 0.1
| pH=10
|
(1)从甲组情况分析,如何判断HA是强酸还弱酸?
。
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)= mol/L。
(Ⅱ)某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB- H++B2-
H++B2-
回答下列问题:
(5)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(B2-)+c(HB-)=0.1 mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
3、简答题 某酸碱指示剂是一种有机弱酸,其在水溶液中的电离平衡与其呈颜色有关:HIn(红色)?H++In-(黄色),若向含此指示剂的溶液中加入盐酸,溶液呈______色.若向此溶液中加入氢氧钠,溶液呈______色.
4、选择题 有关电解质溶液的叙述,下列说法中正确的是
A.0.2 mol·L-1氨水中,c(OH-)与c(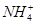 )相等
)相等
B.10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.0.1 mol/L的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S)
D.pH=3的一元酸和pH=11的一元碱等体积混和后的溶液中一定是c(OH-)=c(H+)
5、选择题 化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
HIn(aq) H+(aq) + In-(aq)
H+(aq) + In-(aq)
红色 黄色
浓度为0.02 mol·L-1的下列各溶液:
①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液 ⑤NaHCO3溶液 ⑥氨水,
其中能使指示剂显红色的是
A.①④
B.②⑤⑥
C.①④⑤
D.②③⑥