|
|
|
高中化学必备知识点《水的电离平衡》考点特训(2017年冲刺版)(三)
2018-03-17 05:47:15
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、计算题 (16分)常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸。溶液的PH值的变化关系如右图所示。
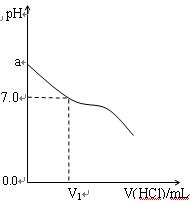
(1) a >7.0的理由是(用离子方程式表示)
(2)如图,当加入稀盐酸的体积为V1mL时,溶液的pH值
刚好为7.0。此时溶液中c(Cl-) c(CH3COOH)
(填<、>或=)。简要写出判断依据
。
(3)当加入的盐酸的体积为20.0mL时,测定溶液中的c(H+)为1.3×10-3 mol/L,求CH3COOH的电离平衡常数Ka(设混合后的体积为二者的体积之和,计算结果保留两位有效数字)。
2、选择题 当用标准盐酸溶液滴定待测氢氧化钠溶液时,下列操作中会使测定结果偏低的是( )
A.用酸式滴定管滴至终点时,俯视滴定管读数
B.将碱液移入锥形瓶后,加了10 ml蒸馏水再滴定
C.酸式滴定管用蒸馏水润洗后,未用标准盐酸溶液润洗
D.酸式滴定管注入酸液时,尖嘴处留有气泡,达滴定终点时气泡消失
|
3、选择题 向体积为Va的0.1mol·L-1 CH3COOH溶液中加入体积为Vb的0.1mol·L-1 KOH溶液,下列关系错误的是( )
A.Va>Vb时:c(CH3COOH) + c(CH3COO-)> c(K+)
B.Va=Vb时:c(CH3COOH) + c(H+) = c(OH-)
C.Va<Vb时:c(CH3COO-) > c(K+)> c(OH-)>(H+)
D.Va与Vb任意比时:c(K+)+ c(H+) =c(OH-)+ c(CH3COO-)
|
4、选择题 室温时,pH=10的氨水和Na2CO3溶液中,水电离产生的C(OH-)前者与后者之比( )
A.1:1
B.10?10:10?4
C.10?4:10?10
D.10?10:10?7
5、填空题 7分)某温度(t℃)时,水的KW=1×10-13,则该温度(填大于、等于或小于) 25℃,理由是 。
将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
(1)若所得混合溶液为中性,则a:b= ;
(2)若所得混合溶液pH=2,则a:b= 。