1、填空题 在一个容积为5L的密闭容器中,通入NH3和O2,它们的物质的量之比为1:2,发生如下反应:4NH3+5O2
4NO+6H2O(g).
(1)上述反应在一定条件下2min后达到平衡,含NH32mol,已知NH3的转化率20%,若以NO浓度变化表示该反应的平均反应速率为______,O2的平衡浓度为______.
(2)在达到平衡后,加入相当于原组成气体1倍的惰性气体,如果容器的容积不变,则平衡______移动;如果保持总压强不变,则平衡______?移动.
参考答案:(1)根据三段式解题法,表示出反应混合物各组分物质的量的变化量、平衡时各组分的物质的量.
令开始通入的氨气的物质的量为nmol,则
? ?4NH3 +5O2

4NO+6H2O,
开始(mol):n? 2n? ? ?0? 0
变化(mol):0.2n? 0.25n?0.2n? 0.3n
平衡(mol):0.8n?1.75n? 0.2n? 0.3n
所以0.8n=2,解得n=2.5
以NO表示的平均反应速率为v(NO)=2.5mol×0.25L2min=0.05mol/(L?min).
O2的平衡浓度为2.5mol×1.755L=0.875mol/L.
故答案为:0.05mol/(L?min);0.875mol/L
(2)容积不变,加入惰性气体,反应混合物各组分的浓度不变,平衡不移动;
总压强不变,容器容积增大,等效为减小压强,平衡向体积增大的方向移动,即向右移动.
故答案为:不;向右
本题解析:
本题难度:一般
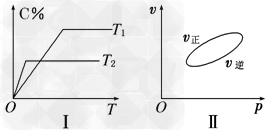
2、选择题 可逆反应aA(g)+bB(g)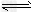 cC(g)+dD(s) ΔH=Q?kJ/mol,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图Ⅰ所示,反应速率(v)与压强(p)的关系如图Ⅱ所示.据图分析,以下说法正确的是
cC(g)+dD(s) ΔH=Q?kJ/mol,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图Ⅰ所示,反应速率(v)与压强(p)的关系如图Ⅱ所示.据图分析,以下说法正确的是
[? ]
A.T1<T2,Q>0
B.增大压强,B的转化率减小
C.当反应达到平衡时,混合气体的密度不再变?化
D.a+b>c+d
参考答案:C
本题解析:
本题难度:一般
3、选择题 当密闭容器中反应mA(g)+nB(s)?pC(g)已经达到平衡后,将密闭容器的体积缩小,发现A的转化率也随之降低.那么,下列几个表示化学方程式化学计量数关系的式子中,普遍适用于上述一类反应的是( )
A.m+n>p
B.m+n<p
C.m>p
D.m<p
参考答案:将密闭容器的体积缩小,则反应体系的压强增大,增大压强,A的转化率减小,则平衡向逆反应方向移动,增大压强平衡向气体体积减小的方向移动,所以m<p,故选D.
本题解析:
本题难度:一般
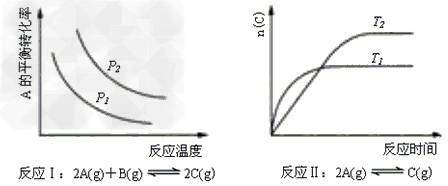
4、选择题 某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P 表示压强,T 表示温度,n 表示物质的量):根据以上规律判断,上列结论正确的是
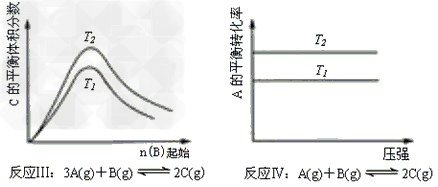
[? ? ]
A.反应Ⅰ:△H>0,P2>P1?
B.反应Ⅱ:△H>0,T1>T2
C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1?
D.反应Ⅳ:△H<0,T2>T1
参考答案:C
本题解析:
本题难度:一般
5、选择题 在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:
Ni(s)+4CO(g)  Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表,下列说法正确的是
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表,下列说法正确的是
温度/℃
| 25
| 80
| 230
|
平衡常数
| 5×104
| 2
| 1.9×10-5
|
A.上述生成Ni(CO)4的反应为吸热反应
B.25 ℃时,反应Ni(CO)4(g)  Ni(s)+4CO(g)的平衡常数为2×10-5
Ni(s)+4CO(g)的平衡常数为2×10-5
C.80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol·L-1
D.80 ℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol·L-1,则此时υ(正)>υ(逆)
参考答案:BC
本题解析:A、根据表中数据可知,随着温度的升高,平衡常数逐渐减小。这说明升高温度平衡向逆反应方向移动,因此正反应是放热反应,A错误;B、逆反应的平衡常数是正反应平衡常数的倒数,则25℃时反应Ni(CO)4(g)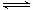 Ni(s)+4CO(g)的平衡常数为1/50000=2×10-5,B正确;C、80℃达到平衡时,n(CO)=0.3 mol,[ Ni(CO)4]/1=2,Ni(CO)4的平衡浓度为2 mol·L-1,C正确;D.在某条件下达到平衡,测得Ni(CO)4、CO浓度均为0.5mol/L,则此时0.5/0.54=8。由于正反应是放热反应,所以此时温度小于80℃,D错误;选BC。
Ni(s)+4CO(g)的平衡常数为1/50000=2×10-5,B正确;C、80℃达到平衡时,n(CO)=0.3 mol,[ Ni(CO)4]/1=2,Ni(CO)4的平衡浓度为2 mol·L-1,C正确;D.在某条件下达到平衡,测得Ni(CO)4、CO浓度均为0.5mol/L,则此时0.5/0.54=8。由于正反应是放热反应,所以此时温度小于80℃,D错误;选BC。
考点:考查平衡常数的判断和应用、外界条件对平衡状态的影响。
本题难度:一般