|
高考化学知识点整理《化学平衡》高频考点特训(2017年练习版)(四)
2018-03-17 05:50:05
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、填空题 (4分)对于下列反应:2SO2 + O2?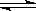 ?2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为________ mol/(L·min),如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______ mol/L。 ?2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为________ mol/(L·min),如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______ mol/L。
参考答案:(1)2 mol/(L·min)?(2)2 mol/L
本题解析:化学反应速率是用单位时间内反应物浓度的减少或生成物浓度的增加来表示。2min内二氧化硫浓度变化为4mol/L,所以二氧化硫反应速率为2 mol/(L·min)。二氧化硫的速率等于氧气速率的二倍,所以二氧化硫的速率为1 mol/(L·min),二氧化硫浓度变化为2 mol/L,所以此时二氧化硫浓度为2 mol/L。
点评:掌握化学反应速率计算公式。
本题难度:一般
2、选择题 在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2L(?)此反应符合下面图象,下列叙述正确的是( )
A.正反应放热,L是气体
B.正反应吸热,L是固体
C.正反应吸热,L是气体
D.正反应放热,L是固体或液体
| 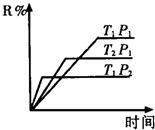
参考答案:A
本题解析:
本题难度:简单
3、填空题 (14分)在一密闭容器中充入1molH2和1molI2,压强为p(Pa),并在一定温度下使发生反应:I2(g) + H2(g) 2HI(g) △H<0。 2HI(g) △H<0。
(1)保持容器容积不变,向其中加入1molH2,反应速率 (填“增大”、“减小”或“不变”,下同);保持容器容积不变,向其中加入1molN2(N2不参加反应),反应速率 。
(2)保持容器内气体压强不变,向其中加入1molN2(N2不参加反应),反应速率 ;保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),反应速率 。
(3)若容器体积为10L,反应达平衡时,测得c(H2)=0.08mol/L,则该反应的平衡常数K= 。
(4)在上述温度下,该10L容器中若通入H2和I2蒸气各2mol,则达到平衡时c (H2)= 。
参考答案:(1)增大(2分);不变(2分)。(2)减小(2分);不变(2分)。(3)0.25(3分)。(4)0.16mol/L(3分)。
本题解析: (1)保持容器容积不变,向其中加入1molH2,即增大了反应物的浓度,反应速率增大;保持容器容积不变,向其中加入1molN2,由于N2不参加反应,所以反应物的浓度不变,因此反应速率不变;(2)保持容器内气体压强不变,向其中加入1molN2,因为N2不参加反应,容器的容积扩大,对于反应物来说,浓度减小,所以化学反应速率减小;保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),由于反应物的浓度不变,所以化学反应速率也不变;(3)若容器体积为10L,反应达平衡时,测得c(H2)=0.08mol/L,则c(I2)="0.08mol/L;" c(HI)=0.04mol/L,所以该反应的平衡常数K= ;(4)由于温度不变,所以化学平衡常数就不变,在温度下,该10L容器中若通入H2和I2蒸气各2mol,假设达到平衡时H2的浓度是x,则达到平衡时K= ;(4)由于温度不变,所以化学平衡常数就不变,在温度下,该10L容器中若通入H2和I2蒸气各2mol,假设达到平衡时H2的浓度是x,则达到平衡时K=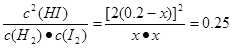 ,解得x="c" (H2)= 0.16mol/L。 ,解得x="c" (H2)= 0.16mol/L。
考点:考查化学反应速率的影响因素、比较计算和化学平衡常数的计算与应用的知识。
本题难度:困难
4、填空题 一定条件下,可逆反应N2+3H2?2NH3△H<0,达到平衡后,
(1)加催化剂,V正、V逆都发生变化,且变化的倍数______(选填:相等.不相等)
(2)缩小体积使体系压强增大,则V正______,V逆______(选填:增大、减小、不变)V正变化的倍数______V逆变化的倍数(选填:大于、小于、等于)
(3)降温,V正、______V逆______(选填:增大、减小、不变),
(4)恒容下再通入一定量的氮气,达新平衡时,N2转换率______,H2转化率______(选填:增大、减小、不变).
参考答案:(1)催化剂能同等程度的改变正逆反应速率,所以正逆反应速率变化的倍数相等,故答案为:相等;
(2)增大压强,增大了单位体积内活化分子的个数,所以正逆反应速率都增大,但正反应速率变化的倍数大于逆反应速率变化的倍数,所以平衡向正反应方向移动,
故答案为:增大;增大;大于;
(?3)降低温度,降低了正逆反应的活化分子百分数,所以正逆反应速率都减小,故答案为:减小;减小;
(4)恒容下再通入一定量的氮气,氮气浓度增大,平衡向正反应方向移动,所以氢气的转化率增大,但加入氮气大于氮气转化的量,所以氮气的转化率减小,
故答案为:减小;增大.
本题解析:
本题难度:一般
5、选择题 下列图示与对应的叙述相符的是(?)
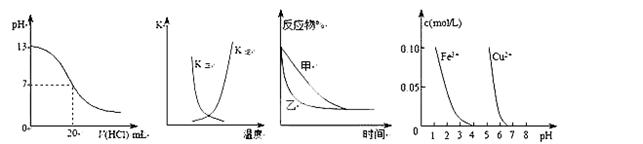
①?②?③?④
A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2A(g) + B(g) 2C(g) ΔH > 0,正、逆反应的平衡常数K随温度的变化 2C(g) ΔH > 0,正、逆反应的平衡常数K随温度的变化
C.图③表示压强对可逆反应2A(g)+2B(g)  3C(g)+D(s)的影响,乙的压强比甲的压强大 3C(g)+D(s)的影响,乙的压强比甲的压强大
D.据图④若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右。
参考答案:D
本题解析:A.当加入盐酸20mL时,pH发生骤变,题中pH变化曲线不正确,如下图,A错误
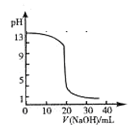
B.反应2A(g)+B(g) 2C(g)△H>0,温度升高反应正向进行,正反应速率大于逆反应速率,故B错误;C.2A(g)+2B(g) 2C(g)△H>0,温度升高反应正向进行,正反应速率大于逆反应速率,故B错误;C.2A(g)+2B(g) 3C(g)+D(s)反应是气体体积变化的反应,压强改变,平衡发生移动,故C错误;D.若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在3-4左右,铁离子沉淀完全,D正确;故选D. 3C(g)+D(s)反应是气体体积变化的反应,压强改变,平衡发生移动,故C错误;D.若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在3-4左右,铁离子沉淀完全,D正确;故选D.
本题难度:一般
| 