1、选择题 下列实验方案合理的是
A.检验混合离子溶液中的SO42-:加入HCl酸化的Ba(NO3)2溶液,观察有无白色沉淀生成
B.除去NO中混有的少量NO2:将混合气体通入水中,再用排空气法收集NO
C.配制浓度为0.1mol/L的NaOH溶液:将0.05molNaOH溶于500mL水配成溶液
D.检验氯化铁溶液中是否混有Cu2+:纸上层析后用氨熏
参考答案:D
本题解析:略
本题难度:一般
2、实验题 )单晶硅是信息产业中重要的基础材料。工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4和CO,SiCl4经提纯后用氢气还原得高纯硅。以下是实验室制备SiCl4的装置示意图。
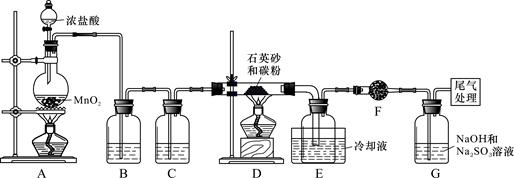
实验过程中,石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4、AlCl3、FeCl3遇水均易水解,有关物质的物理常数见下表:
物质
| SiCl4
| AlCl3
| FeCl3
|
沸点/℃
| 57.7
| -
| 315
|
熔点/℃
| -70.0
| -
| -
|
升华温度/℃
| -
| 180
| 300
|
?
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:_____________, 装置D的硬质玻璃管中发生反应的化学方程式是?。
(2)装置C中的试剂是?; D、E间导管短且粗的原因是?。
(3)G中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和SO42-。请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2的影响)。
【提出假设】假设1:只有SO32-;假设2:既无SO32-也无ClO-;假设3:?。
【设计方案,进行实验】可供选择的实验试剂有:3?mol/L?H2SO4、1?mol/L?NaOH、0.01?mol/L?KMnO4、溴水、淀粉-KI、品红等溶液。
取少量吸收液于试管中,滴加3 mol/L H2SO4至溶液呈酸性,然后将所得溶液分置于a、b、c三支试管中,分别进行下列实验。请完成下表:
序号
| 操?作
| 可能出现的现象
| 结论
|
①
| 向a试管中滴加几滴?溶液
| 若溶液褪色
| 则假设1成立
|
若溶液不褪色
| 则假设2或3成立
|
②
| 向b试管中滴加几滴?溶液
| 若溶液褪色
| 则假设1或3成立
|
若溶液不褪色
| 假设2成立
|
③
| 向c试管中滴加几滴?溶液
| ?
| 假设3成立
|
?
参考答案:(1)MnO2+2Cl-+4H+ Mn2++Cl2↑+2H2O ;SiO2+2C+2Cl2
Mn2++Cl2↑+2H2O ;SiO2+2C+2Cl2 SiCl4+2CO
SiCl4+2CO
(2)浓硫酸;防止生成物中的AlCl3、FeCl3等杂质凝结成固体堵塞导管
(3)【提出假设】假设3:只有ClO-
【设计方案,进行实验】①溴水(或0.01?mol/L?KMnO4溶液)②品红溶液;③淀粉-KI溶液;若溶液变为蓝色
本题解析:(1)装置A中发生的反应是用高锰酸钾和浓盐水在加热的条件下制备氯气,其反应离子方程式MnO2+2Cl-+4H+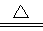 Mn2++Cl2↑+2H2O;氯气经过除杂后在D中和SiO2与C在加热条件下进行反应生成SiCl4和CO,反应化学方程式SiO2+2C+2Cl2
Mn2++Cl2↑+2H2O;氯气经过除杂后在D中和SiO2与C在加热条件下进行反应生成SiCl4和CO,反应化学方程式SiO2+2C+2Cl2 SiCl4+2CO(2)BC中分别为饱和食盐水和浓硫酸用来除去氯气中的HCl和水蒸气;石英砂中的铁、铝等杂质也能转化为相应氯化物,若导管较细使杂质凝结成固体堵塞导管(3)由假设1和假设2得知,要检测的为SO32-和ClO-,故假设3为只有ClO-;又因为SO32-会使KMnO4和溴水,并不与ClO-发生反应,故可以用来检测假设1,而均SO32-和ClO-具有漂白性,会使品红溶液褪色,故可以用来检测假设2;所有试剂中ClO-可以氧化KI使其生成I2,在淀粉溶液中显蓝色,可以用来检测假设3。
SiCl4+2CO(2)BC中分别为饱和食盐水和浓硫酸用来除去氯气中的HCl和水蒸气;石英砂中的铁、铝等杂质也能转化为相应氯化物,若导管较细使杂质凝结成固体堵塞导管(3)由假设1和假设2得知,要检测的为SO32-和ClO-,故假设3为只有ClO-;又因为SO32-会使KMnO4和溴水,并不与ClO-发生反应,故可以用来检测假设1,而均SO32-和ClO-具有漂白性,会使品红溶液褪色,故可以用来检测假设2;所有试剂中ClO-可以氧化KI使其生成I2,在淀粉溶液中显蓝色,可以用来检测假设3。
本题难度:困难
3、实验题 甲苯氧化法制备苯甲酸的反应原理如下:
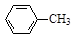 + 2KMnO4
+ 2KMnO4
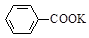 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
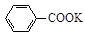 + HCl
+ HCl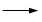
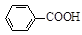 +KCl
+KCl
实验时将一定量的甲苯和KMnO4溶液置于图1装置中,在100 ℃时, 反应一段时间,再停止反应,并按如下流程分离出苯甲酸和回收未反应的甲苯。
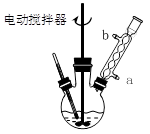 ?
?
图1回流搅拌装置?图2抽滤装置?
⑴实验室中实现操作Ⅰ所需的玻璃仪器有?、烧杯;操作Ⅱ的名称为?。
⑵如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,若无此操作会出现的危害是?。
⑶在操作Ⅲ中,抽滤前需快速冷却溶液,其原因是?;如图2所示抽滤完毕,应先断开?之间的橡皮管。
⑷纯度测定:称取1.220 g产品,配成100 mL溶液,取其中25.00 mL溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3 mol。产品中苯甲酸质量分数为?。
参考答案:⑴分液漏斗?蒸馏?⑵过量的高锰酸钾氧化盐酸,产生氯气
⑶得到较大的苯甲酸晶粒,便于抽滤?抽气泵和安全瓶? ⑷96%(每空2分,共12分)
本题解析:⑴操作I为分液操作,其所需的玻璃仪器有分液漏斗、烧杯;操作II为蒸馏操作得无色液体A。
⑵为了避免过量的高锰酸钾氧化盐酸,产生有毒的氯气,应该先加亚硫酸氢钾除去过量的高锰酸钾,然后再加入浓盐酸酸化。
⑶为了得到较大的苯甲酸晶粒,便于抽滤,应该在抽滤前需快速冷却溶液;为了避免管道里的水在负压下回流,故在抽滤完毕,应先断开抽气泵和安全瓶。
⑷根据“1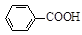 ~1KOH”,则产品中苯甲酸质量分数为
~1KOH”,则产品中苯甲酸质量分数为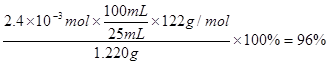 。
。
本题难度:一般
4、选择题 有NaCl、FeCl2、FeCl3、MgCl2、AlCl3、NH4Cl六种溶液,只用一种试剂就可把它们鉴别开来,这种试剂是
A.盐酸
B.烧碱溶液
C.氨水
D.KSCN溶液
参考答案:B
本题解析:当盐溶液中酸根离子相同,而金属阳离子不同时,要选择碱溶液来鉴别。由于不同的金属阳离子与OH-离子发生反应产生的金属氢氧化物沉淀的颜色一般不同。可根据不同的实验现象加以区分。NaCl加入氢氧化钠溶液无现象;FeCl2加入氢氧化钠溶液首先产生白色沉淀,白色沉淀迅速变为灰绿色,最后变为红褐色;FeCl3加入氢氧化钠溶液产生红褐色沉淀;MgCl2加入氢氧化钠溶液首先产生白色沉淀;AlCl3加入氢氧化钠溶液少量时产生白色沉淀,过量时沉淀又逐渐溶解;NH4Cl加入氢氧化钠溶液,有刺激性气味的气体产生。各个溶液现象不同,因而可以区分。
本题难度:一般
5、填空题 (8分)设计一个实验证明明矾晶体KAl(SO4)2·12H2O中含有K+、Al3+、 和H2O。
和H2O。
?
?
参考答案:(1)确定结晶水:取少量晶体,放入试管中,用酒精灯加热在试管口有液体生成,且可使白色无水硫酸铜粉末变蓝色,证明明矾中含结晶水
(2)确定K+:用一支洁净的铂丝沾取少量试样,在酒精灯火焰上灼烧,透过蓝色的钴玻璃片观察火焰呈紫色,确定含K+。
(3)确定Al3+:一支试管中滴加少量NaOH溶液,出现白色沉淀,继续加入过量NaOH溶液,白色沉淀溶解。(不考虑Zn(OH)2)
(4)确定 :第二支试管中先加盐酸溶液,如无现象,证明无
:第二支试管中先加盐酸溶液,如无现象,证明无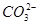 、
、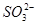 存在,再加入BaCl2溶液生成白色沉淀证明溶液中含
存在,再加入BaCl2溶液生成白色沉淀证明溶液中含
本题解析:考察离子的检验。钾离子一般用焰色反应。根据氢氧化铝是两性氢氧化物,可检验铝离子。 用钡盐检验。水一般用无水硫酸铜检验。
用钡盐检验。水一般用无水硫酸铜检验。
本题难度:一般