1、选择题 实验室合成氨装置如图所示,则以下说法中错误的是( )
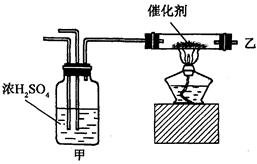
A.装置甲的作用是干燥
B.装置甲的作用是化合
C.乙处导出的气体是 ,
, ,
,
D.检验产物的简单化学方法是用湿润的石蕊试纸或浓盐酸等
参考答案:B
本题解析:甲的作用是干燥、调节气流并混合气体.
本题难度:一般
2、实验题 今用铝、稀硫酸和氢氧化钠溶液为原料,在实验室制备一定量的氢氧化铝。可分别采用如下化学方程式所表示的两种方法:
①2Al+3H2SO4=Al2(SO4)3 +3H2↑
Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4
②2Al+2NaOH +2H2O=2NaAlO2 +3H2↑
2NaAlO2+ H2SO4+ 2H2O=2Al(OH)3↓+Na2SO4
(1)上述哪一种方法比较节约试剂[提示:试从每生产2 mol Al(OH)3所耗费的试剂用量予以说明]
(2)原料相同,请设计一种更为节约试剂的方法(说明其可以节约试剂的根据)。
参考答案:(1)后一种方法比较节约试剂。
(2)用2 mol Al中的0.5 mol Al与H2SO4反应(消耗 mol H2SO4)生成0.5 mol Al3+;
mol H2SO4)生成0.5 mol Al3+;
用2 mol Al中的1.5 mol Al与NaOH 反应(消耗1.5 mol NaOH)生成1.5 mol AlO2-;
二者混合生成 2 mol Al(OH)3。
本题解析:
本题难度:一般
3、填空题 (12分)二氯烯丹是一种播前除草剂,其合成路线如下:
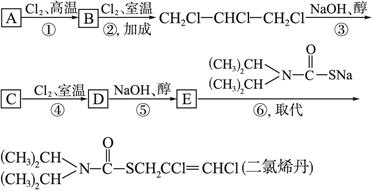
且D在反应⑤中所生成的E,其结构只有一种可能。
(1)写出下列反应的类型:反应①是____________,反应③是____________。
(2)写出下列物质的结构简式:A:____________,?C:____________?,D:____________,E:____________。
参考答案:(1)取代反应 消去反应?
(2)CH2==CH—CH3?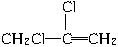
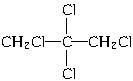 CHCl==CCl—CH2Cl
CHCl==CCl—CH2Cl
本题解析:A与Cl2反应生成B,B又与Cl2发生加成反应生成CH2Cl—CHCl—CH2Cl,则B为CH2==CH—CH2Cl,A的结构简式为CH2==CH—CH3,即A与Cl2发生的是取代反应。CH2Cl—CHCl—CH2Cl?在NaOH醇溶液中发生消去反应生成C,但仅由此条件无法确定C的结构。依据官能团的性质及所给的转化条件可知,C与Cl2发生加成反应生成D,D经消去反应生成E。由二氯烯丹的结构逆向推导可知E的结构为CHCl==CCl—CH2Cl,D发生消去反应生成的E只有一种结构,则D的结构为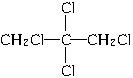 ,C的结构简式为
,C的结构简式为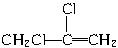 。
。
本题难度:简单
4、填空题 下面是甲、乙、丙、丁四个种群,在一个达到生态平衡的环境中所含有的总能量和残留农药DDT的平均浓度。
种群
| 甲
| 乙
| 丙
| 丁
|
能量(kJ)
| 2.8×109
| 1.3×108
| 9.1×107
| 2.9×107
|
DDT浓度(ppm)
| 0.04
| 0.35
| 0.39
| 3.4
|
(1)这四个种群中属于生产者的是______________。
(2)写出四个种群的能量流动的渠道_______________________________。
(3)在能量流动的渠道中_____________越高,生物体内的DDT浓度也越高。
参考答案:(1)甲?(2)甲→乙→丁?甲→丙→丁?(3)营养级
本题解析:按生态系统中能量逐级递减的原理,甲的总能量最多,一定是生产者。
理由同上题,乙、丙总能量的数量比较接近,且DDT浓度相当,所以位于同一营养级。因汞等有毒金属不易分解,在食物链中富集,所以随营养级越高,总能量减少,其浓度就越高。
本题难度:简单
5、填空题 (15分)氯碱工业是高耗能产业,为了提高原料的利用率,将电解的Y气体作为燃料电池燃料,为电解池供电;X气体作为钛的冶炼原料,在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中氯碱工业装置中的电极未标出,所用的离子膜都只允许阳离子通过。如下图所示:
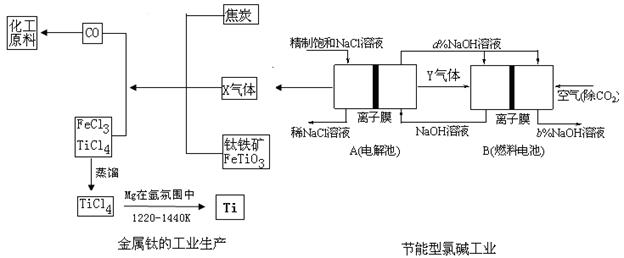
(1)①上图中的节能型氯碱工业部分,X、Y分别是_______、_______(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:__________________________;负极:____________________________;
③这样设计的主要节(电)能之处在于(写出2处)_______________、____________。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式?。
(3)TiCl4暴露在潮湿空气中冒白烟,白烟主要为白色的二氧化钛的水合物H2Ti03,写出该反应的化学方程式?。
(4)已知:①Mg(s)+Cl2 (g)=MgCl2 (g)?△H=-641kJ·mol-1
②1/2Ti(s)+Cl2 (g)=1/2TiCl4 (l)?△H="-385" kJ·mol-1
写出Mg与TiCl4反应的热化学方程式?,
反应在氩气氛中进行的理由是?。
参考答案:
(1)①Cl2,H2(2分)a%<b% (1分) ②O2+4e-+2H2O=4OH-? H2-2e-+2OH-=2H2O(2分)③燃料电池可以补充电解池消耗的电能;提高产品碱液的浓度,降低能耗(其他合理答案也给分)(2分)
(2)2FeTiO3+6C+7Cl2 2FeCl3+2TiCl4+6CO(2分)
2FeCl3+2TiCl4+6CO(2分)
(3)TiCl4+3H2O=H2TiO3+4HCl (2分)
(4)2Mg(s)+TiCl4(l)=2MgCl2(s)+Ti(s);△H="-512" kJ·mol-1(3分)
Mg和Ti都有强还原性,在氩气中可以防止被氧化(1分)
本题解析:(1)燃料电池中,通入空气一极为正极,通入燃料气一极为负极。①Y为氢气,氢气产生于电解池的阴极,推知产生电解池阳极的X为氯气;负极:H2-2e-+2OH-=2H2O,水增多,OH-减少,变稀,正极:O2+4e-+2H2O=4OH-,水减少,OH-增多,所以正极附近氢氧化钠溶液浓度变大,即a<b。注意,离子膜都只允许阳离子通过(水也不能通过)。(2)由流程图知,反应物为Cl2、C、FeTiO3,生成为FeCl3、TiCl4和CO (3)依题意,四氯化钛与水反应生成钛酸和氯化氢(4)由盖斯定律知,①×2-②×2得热化学反应方程式及反应热。
本题难度:一般