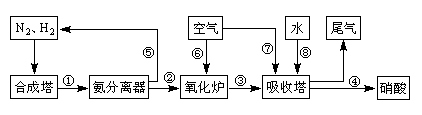
1、实验题 (13分)工业合成氨与制备硝酸一般可连续生产,流程如下:
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g)?△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____300℃(填“>”、“<”或“=”)。
2NH3(g)?△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____300℃(填“>”、“<”或“=”)。
T/℃
| T1
| 300
| T2
|
K
| 1.00×107
| 2.45×105
| 1.88×103
|
(3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率如图所示。温度高于900℃时,NH3产率下降的原因?。

(4)在上述流程图中,氧化炉中发生反应的化学方程式为___________。
(5)硝酸厂的尾气直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)?△H= -574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g) +2H2O(g)?△H= -1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:________________________。
(6)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式____________________,科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是__________(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为_______________________。
2、选择题 下列物质不能跟硫酸铵肥料混合施用的是( )
A.碳酸氢铵
B.草木灰
C.过磷酸钙
D.氯化钾
3、选择题 绿色化学的最大特点在于它是在始端就采用实现污染预防的科学手段,因而过程和终端均为零排放或零污染。绿色化学主张在通过化学转换获取新物质的过程中充分利用每个原子,具有“原子经济性”,因此它既能够充分利用资源,又能够防止污染。下列化学反应,不符合绿色化学概念的是
[? ]
A.制Cu(NO3)2: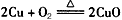 , CuO+2HNO3(稀) = Cu(NO3)2+H2O
, CuO+2HNO3(稀) = Cu(NO3)2+H2O
B.消除制硝酸工业尾气的氮氧化物污染 NO2+NO+2NaOH = 2NaNO2+ H2O, 2NO2+2NaOH = NaNO2+NaNO3+H2O
C.利用二氧化碳制造易降解塑料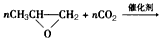
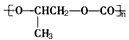
D.用铜与浓硫酸共热制硫酸铜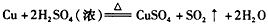
4、选择题 化学与能源开发、环境保护、资源利用等密切相关.下列说法正确的是( )
A.为提高农作物的产量和质量,应大量使用化肥和农药
B.绿色化学的核心是应用化学原理对环境污染进行治理
C.实现化石燃料清洁利用,就无需开发新能源
D.垃圾是放错地方的资源,应分类回收利用
5、填空题 (10分)烧结法制氧化铝生产过程如下:
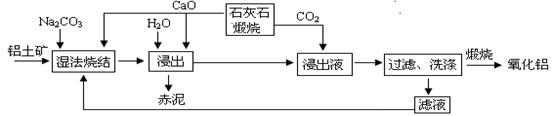
已知:①铝土矿主要成分为:Al2O3、SiO2、Fe2O3和TiO2。?②高温烧结时,Al2O3、Fe2O3、TiO2都能发生反应分别生成NaAlO2、Na2Fe 2O4和难溶于水的CaTiO3。
请回答下列问题:
(1)Na2Fe2O4遇水便发生水解反应生成Fe(OH)3,写出Na2Fe2O4水解化学反应方程式? ▲ 。
(2)浸出时再加入CaO的目的是? ▲?。
(3)浸出液中发生的生成Al(OH)3的离子反应方程式? ▲?。
(4)滤液的主要成分是? ▲?(写化学式);滤液循环使用的优点? ▲?。(任答一点)